题目内容
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂(易被氧化),某研究性学习小组为了制备少Na2S2O5,并探究SO2的某些性质,设计下图所示装置(夹持装置已略去)。请回答下列问题。
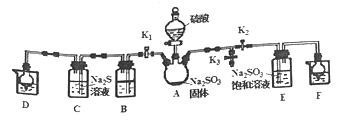
(1)向A中滴加的硫酸最好选用______(填字母)。
A.98%的浓硫酸 B.70%的硫酸 C.10%的稀硫酸
(2)打开分液漏斗旋塞,发现其中的液体不能流下,应采取的操作是___________.
(3)装入药品后,打开K1、K2、K3并从K3处通入一段时间的N2,其目的是______,N2充满装置后再关闭K1、K3,打开K2,滴入硫酸后E中有Na2S2O5晶体析出,装置E中的反应方程式为_____
(4)关闭K2、K3,打开K1,若探究SO2的漂白性,装置B应盛有_____溶液,若B中所装溶液为酸性KMnO4溶液,B中发生反应的离子方程式为______,B中紫色完全褪去后,继续滴加硫酸,则装置C中观察到的现象是__________。
(5)若B中为新制的氯水,将SO2通入其中,请设计简单实验验证二者是否恰好完全反应(简要描述实验步骤、现象和结论)
仪器自选,供选择试剂:滴加酚酞的氢氧化钠溶液、氯化亚铁溶液、硫氰化钾溶液、品红溶液。
___________________________________________________。
【答案】 B 关闭分液漏斗活塞,再打开上端的玻璃塞,再打开分液漏斗活塞 排除装置内的空气 SO2+Na2SO3=Na2S2O5 品红 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ 有黄色沉淀生成 取少量溶液,向其中加入品红溶液,若品红济液不褪色,说明二者恰好完全反应,否则,二者未完全反应.
【解析】(1)反应中的硫酸不能用98%的浓硫酸,因98%的浓硫酸中水很少,硫酸是以分子的形式存在,而亚硫酸钠和硫酸反应是在硫酸电离成离子的条件下进行的,故A错误,10%的稀硫酸,浓度太小反应速率较慢,所以最好用70%的硫酸,故B正确。(2)液体不能流下是因为分液漏斗中压强低于外界压强,要想使其顺利流下应打开上端的玻璃塞或使分液漏斗玻璃塞上的凹槽或小孔对准瓶颈处的小孔。这样内外压强相等,液体可以顺利流下。(3)因生成的焦亚硫酸钠易被氧化,所以应让反应生成的二氧化硫排净装置中的空气。在E中二氧化硫和亚硫酸钠反应生成焦亚硫酸钠反应方程式为:SO2+Na2SO3=Na2S2O5(4)二氧化硫能使品红褪色,表现其漂白性。二氧化硫也具有较强的还原性,能被强氧化剂酸性高锰酸钾溶液氧化,对应的离子方程式为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ ,继续滴加硫酸,生成的二氧化硫就可以和硫化钠中的硫根离子反应生成黄色的单质硫,反应为:SO2+4H++2S2-=3S↓+2H2O(5)新制的氯水和SO2都能使品红褪色,两者反应时不管哪种物质有剩余,加品红溶液都能褪色,所以可向反应体系中加品红,若褪色,证明两者有一种有剩余,若不褪色,证明两者恰好完全反应。