题目内容
【题目】元素周期表第四周期共有18种元素。回答下列问题:
(l)第四周期元素的基态原子中,最高能层中的s轨道上只有一个电子的元素有_____;
镍元素基态原子的电子排布式为____;p区元素第一电离能由大到小的前三种元素依次为____;
(2)GaBr3、GeBr4、AsBr3、AsBr5中,中心原子的轨道杂化类型为sp3的化合物是____;分子的立体构型为平面三角形的化合物是_____;AsBr5的分子构型为 ,则AsBr5是_____(填“极性”或“非极性”)分子。
,则AsBr5是_____(填“极性”或“非极性”)分子。
(3)已知GaF3的沸点为19.5℃、GaC13的沸点为201.3℃、GaBr3的沸点为292℃,导致沸点如此变化的原因是___________.
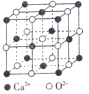
(4)Ca、CaO、CaC12等含钙物质的焰色均为砖红色,焰色形成的原因是钙元素在一定条件下产生原子_______光谱。CaO晶胞如图所示,CaO晶体中Ca2+的配位数为____;若CaO的密度为dg/cm3,则CaO的晶胞参数a=__________nm。
【答案】 K、Cr、Cu 1s22s22p63s23p63d84s2(或[Ar] 3d84s2) Kr>Br>As GeBr4、AsBr3 GaBr3 非极性 GaF3、GaCl3、GaBr3均是分子晶体,范德华力随着相对分子质量的增大而增大,故沸点依次升高 发射 6 ![]()
【解析】(1)考查核外电子排布规律、电子排布式、第一电离能的规律,第四周期中最高能层的s轨道上只有1个电子,注意电子稳定状态,因此有K、Cr、Cu;Ni位于第四周期VIII族,28号元素,因此核外电子排布式为1s22s22p63s23p63d84s2(或[Ar] 3d84s2);同周期从左向右第一电离能增大,但IIA>IIIA、VA>VIA,因此由大到小前三种元素依次为Kr>Br>As;(2)考查杂化类型的判断、空间构型、(非)极性分子的判断,GaBr3中心原子有3个σ键,孤电子对数为(3-3×1)/2=0,因此杂化类型为sp2,GeBr4中心原子有4个σ键,孤电子对数为(4-4×1)/2=0,杂化类型为sp4,AsBr3中心原子为3个σ键,孤电子对数为(5-3×1)/2=1.杂化类型为sp3,AsBr5中心原子是5个σ键,孤电子对数为(5-5×1)/2=0,杂化类型为sp3d,空间构型分别是平面三角形、正四面体、三角锥形、三角双锥,AsBr5是对称结构,因此属于非极性分子;(3)考查晶体熔沸点比较,三种物质沸点较低,属于分子晶体,范德华力随着相对分子质量的增大而增大,故沸点依次升高 ; (4)考查配位数、晶胞的计算,焰色形成原因是钙元素在一定条件下产生原子的发射光谱,CaO是离子键,距离某离子最近的异性离子的个数,根据晶胞,Ca2+的配位数为6,Ca2+位于晶胞的顶点和面心,个数为8×1/8+6×1/2=4,O2-位于晶胞的棱上和体心,个数为12×1/4+1=4,因此晶胞的质量为4×56/NAg,晶胞的体积为(a×10-7)3,根据密度的定义,d=4×56/[ NA×(a×10-7)3] ,解得a=![]() 。
。