题目内容
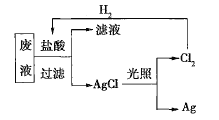
【题目】实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠、碳酸氢铵的氯化钠。某学生设计了如下方案:
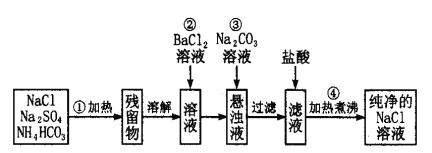
请回答下列问题:
(1)操作①可在什么仪器中进行?(填序号)__________。
A. 烧瓶 B. 坩埚 C. 容量瓶
(2)操作②发生的离子反应方程式为______________________________。
(3)操作②是否可改为加硝酸钡溶液?为什么?______________________。
(4)进行操作②后,如何判断SO42-已除尽,方法是____________________________________。
【答案】B SO42-+ Ba2+= BaSO4↓ 不能使用硝酸钡,会引入新的杂质NO3- 将所得溶液静置,在上层清液中加入BaCl2溶液,若无白色沉淀生成,说明SO42-已除尽
【解析】
混有硫酸钠、碳酸氢铵的氯化钠加热后,碳酸氢铵受热分解,残留物为硫酸钠和氯化钠,溶解后向溶液中加入过量BaCl2溶液后,SO42-与Ba2+结合生成白色沉淀硫酸钡,加入碳酸钠溶液除去过量的Ba2+,将沉淀过滤后加入盐酸得到含有少量盐酸的氯化钠溶液,加热煮沸除去盐酸后可得纯净的氯化钠溶液。
(1)加热固体混合物可在坩埚中进行;
(2)操作②中发生的是BaCl2和Na2SO4的反应,生成了BaSO4和NaCl,离子方程式为:SO42-+ Ba2+= BaSO4↓;
(3)不能使用硝酸钡,会引入新的杂质NO3-,不符合分离和提纯的原则;
(4)将所得溶液静置,在上层清液中加入BaCl2溶液,若无白色沉淀生成,说明SO42-已除尽。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目