题目内容
【题目】氟在自然界中常以CaF2的形式存在。
(1)下列关于CaF2的表述正确的是_____。
a.Ca2+ 与F﹣间仅存在静电吸引作用
b.F﹣的离子半径小于Cl﹣,则CaF2的熔点高于CaCl2
c.阴阳离子比为2∶1的物质,均与CaF2晶体构型相同
d.CaF2中的化学键为离子键,因此CaF2在熔融状态下能导电
(2)CaF2难溶于水,但可溶于含Al3+的溶液中,原因是 _____________________(用离子方程式表示)。
(3)F2通入稀NaOH溶液中可生成OF2,OF2分子构型为_____,其中氧原子的杂化方式为____。
(4)F2与其他卤素单质反应可以形成卤素互化物,例如ClF3、BrF3等。已知反应Cl2(g)+3F2(g)═2ClF3(g)△H=﹣313kJmol﹣1,F﹣F键能159kJmol﹣1,Cl﹣Cl键的键能为242kJmol﹣1,则ClF3中Cl﹣F键的平均键能为________ kJmol﹣1,ClF3的熔、沸点比BrF3的_____(填“高”或“低”)。
(5)如图为CaF2、H3BO3(层状结构,层内的H3BO3分子通过氢键结合)、金属铜三种晶体的结构示意图,请回答下列问题:
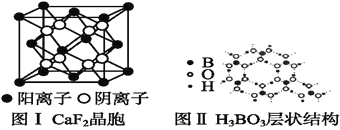
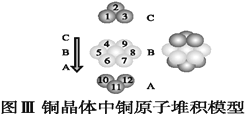
①图Ⅰ所示的CaF2晶胞中与Ca2+最近且等距离的F-数为____,图Ⅲ中未标号的铜原子形成晶体后周围最紧邻的铜原子数为____。
②图Ⅱ所示的物质结构中最外层已达8电子结构的原子是____。H3BO3晶体中B原子个数与极性键个数比为____。
③三种晶体中熔点最低的是____,其晶体受热熔化时,克服的微粒之间的相互作用力为________________。
【答案】 bd 3CaF2+Al3+=3Ca2++AlF63﹣ V形 sp3 172 低 8 12 O 1∶6 H3BO3 范德华力和氢键
【解析】(1)Ca2+ 与F﹣间存在离子键,离子键是阴阳离子之间的静电作用,包括吸引和排斥,所以选项a错误。离子晶体的熔点一般取决于晶格能的大小,一般来说电荷相等的前提下,离子半径越小,晶格能越大,所以选项b正确。阴阳离子比为2∶1的物质,有的与CaF2晶体构型相同,有的是反CaF2型,例如:Na2O。选项c错误。CaF2中的化学键为离子键,因此CaF2在熔融状态下离子键被破坏,离子能自由移动所以能导电,选项d正确。
(2)CaF2电离的F-可以与Al3+进行配位,从而使CaF2溶解,反应为:3CaF2 + Al3+ = 3Ca2+ + AlF63﹣。
(3)根据价层电子对互斥理论,OF2的中心原子O的价电子对为4,配位数为2,所以O为sp3杂化,分子为V形或者说是折线形。
(4)反应的焓变等于反应物键能减去生成物键能,设ClF3中Cl﹣F键的平均键能为X kJmol﹣1,有:242+3×159-2×3×X=-313,解方程得到X=172。ClF3和BrF3都是分子晶体,熔沸点高低取决于分子间作用力的大小,而结构相似的前提下,分子间作用力的大小可用分子量的大小判断,分子量越大,作用力越大,熔沸点越高。所以熔沸点应该是ClF3小于BrF3。
(5)①以CaF2顶面中心的Ca2+为例,其与下方的4个四个F-以及其上方的另一个晶胞中的四个F-距离最近,所以CaF2晶胞中与Ca2+最近且等距离的F-数为8。图Ⅲ中Cu为ABC型最紧密堆积,所以每个Cu的配位数都是12。
②H原子不可能达到8电子。B的最外层是3个电子,形成3个共价键最外层是6个电子。O形成两个共价键就是8电子结构(图中三个键一个是氢键)。由图示得到H3BO3的结构为B(OH)3通过氢键形成的层状结构,所以1个B对应了3个O-B和3个O-H,即H3BO3晶体中B原子个数与极性键个数比为1:6。
③H3BO3是分子晶体,应该是其中熔点最低的。晶体熔化的时候应该克服的作用力是分子间作用力和氢键。