题目内容
【题目】C、Be、Cl、Fe等元素及其化合物有重要的应用。
(1)查表得知,Be的电负性是1.5,Cl的电负性是3.0,则BeCl2应为 (填离子或共价)化合物;根据铍元素和铝元素在周期表中的位置,推测BeCl2应与 (填MgCl2或AlCl3)化学性质更相似。
(2)上述四种元素的原子中,未成对电子数最多的元素是_________________。
(3)①试根据原子核外电子排布所遵循的原理解释Fe2+具有较的强还原性,易被氧化为Fe3+的原因 。②当然Fe3+也有氧化性,在印刷行业中就用氯化铁溶液腐蚀铜板,写出离子方程式 。
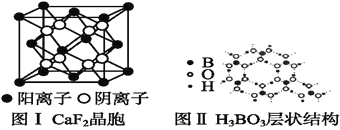
(4)一定条件下,C元素可形成多种晶体。下图1是其中某种晶体的一个晶胞,该晶胞中含有________个C原子。
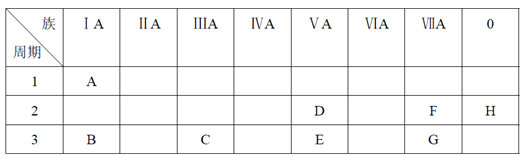
(5)下图2为金属铁某种晶体的晶胞结构,已知铁的摩尔质量是56gmol-1,该晶体的密度为a gcm-3,NA为阿伏加德罗常数的值,则该晶胞的体积为_________cm3。

【答案】(1)共价,AlCl3(2)Fe(3)具有较的强还原性,易被氧化为Fe3+①Fe2+的外围电子排布为3d6,当失去一个电子后变成3d5的半充满结构的Fe3+,较稳定②2Fe3+ +Cu =2Fe2++Cu2+(4)8 (5)112/aNA
【解析】
试题分析:(1)Be的电负性是1.5,Cl的电负性是3.0,3.0-1.5=1.5,电负性的差值小于1.7,所以BeCl2应为共价化合物;铍元素和铝元素在周期表中位于对角线的位置,性质相似,所以BeCl2与AlCl3化学性质更相似。
(2)C、Be、Cl、Fe四种元素中,未成对电子数分别为2、0、1、4,最多的元素是铁。
(3)①Fe2+的外围电子排布为3d6,当失去一个电子后变成3d5的半充满结构的Fe3+,Fe2+较稳定。
②氯化铁与铜反应生成氯化亚铁和氯化铜,反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+。
(4)利用均摊法计算C原子数,8×1/8+6×1/2+4=8,则该晶胞中含有8个碳原子。
(5)由图2可知,该晶胞为体心立方晶胞,一个晶胞中含有铁原子个数为8×1/8+1=2,则该晶胞的体积为V=(2×56)÷(NA×a)=112/aNA。