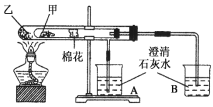
题目内容
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
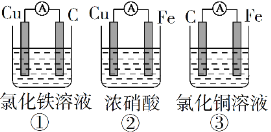
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
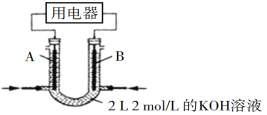
实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
【答案】 ③ Cu2++2e-=Cu 3g B CH4-8e-+10OH-=CO32-+7H2O 9.6mol
【解析】(1)验证Fe2+与Cu2+氧化性强弱,在原电池中,铁作负极、其它导电的活泼性弱于铁的金属或非金属作正极,电解质溶液为可溶性的铜盐;
(2)①根据OH定问移向B电极可知,A为正极、B为负极,据此分析判断。
(1)要验证Fe2+与Cu2+氧化性强弱,在原电池中,铁作负极、其它导电的活泼性弱于铁的金属或非金属作正极,电解质溶液为可溶性的铜盐,则①中铜作负极、C作正极,电池反应式为Cu+2Fe3+=Cu2++2Fe2+,不能验证Fe2+与Cu2+氧化性强弱,错误;②中铁发生钝化现象,Cu作负极、铁作正极,电池反应式为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,不能验证Fe2+与Cu2+氧化性强弱,错误;③中铁作负极、碳棒作正极,电池反应式为:Fe+Cu2+=Cu+Fe2+,能验证Fe2+与Cu2+氧化性强弱,正确;答案选③;③中碳棒作正极,铜离子放电,电极反应式为Cu2++2e-=Cu。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,消耗铁的物质的量是0.05mol÷2=0.025mol,质量是0.025mol×56g/mol=1.4g。析出铜的物质的量是0.025mol,质量是0.025mol×64g/mol=1.6g,所以两个电极的质量差为1.4g+1.6g=3.0g。
(2)根据OH定问移向B电极可知,A为正极、B为负极,则B处电极入口通甲烷,由于溶液显碱性,则其电极反应式为CH4-8e-+10OH-=CO32-+7H2O。当消耗甲院的体积为33.6 L(标准状况下)时,甲烷的物质的量是33.6L÷22.4L/mol=1.5mol,失去电子的物质的量为1.5mol×8=12mol。假设电池的能量转化率为80%,则导线中转移电子的物质的量为12mol×0.8=9.6mol。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
序号 | 硫酸的体积/mL | 锌的质量/g | 锌的形状 | 温度/℃ | 完全溶于酸的时间/s | 生成硫酸锌的质量/g |
1 | 50.0 | 2.0 | 薄片 | 25 | 100 | m1 |
2 | 50.0 | 2.0 | 颗粒 | 25 | 70 | m2 |
3 | 50.0 | 2.0 | 颗粒 | 35 | 35 | m3 |
4 | 50.0 | 2.0 | 粉末 | 25 | 45 | 5.0 |
5 | 50.0 | 6.0 | 粉末 | 35 | 30 | m5 |
6 | 50.0 | 8.0 | 粉末 | 25 | t6 | 16.1 |
7 | 50.0 | 10.0 | 粉末 | 25 | t7 | 16.1 |
(1)化学反应速率本质上是由物质的性质决定的,但外界条件也会影响反应速率的大小。本实验中实验2和实验3对比得出的结论是______________________________。
(2)我们最好选取实验________(填3个实验序号)研究锌的形状对反应速率的影响。
(3)若采用与实验1完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
(4)利用表中数据,可以求得:硫酸的物质的量浓度是________mol/L。
Ⅱ.某温度时,在5 L的容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
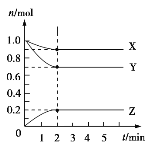
(5)反应开始至2 min,Y的平均反应速率______________________。
(6)分析有关数据,写出X、Y、Z的反应方程式_________________。