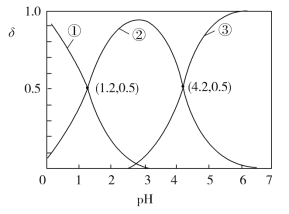
题目内容
【题目】纯橄岩为含镁的硅酸盐矿物,并含有MnO、Fe2O3、FeO、SiO2和一些有机物等杂质。工业上利用纯橄岩制备一水硫酸镁(MgSO4·H2O)的工艺流程如下:
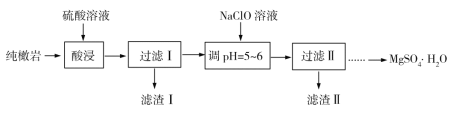
(1)浸出时温度控制在90℃~100℃之间,并且要连续搅拌2小时的目的是___________。
(2)上述流程中多次用到了过滤操作,实验室过滤时需要用到的玻璃仪器是玻璃棒、烧杯和________________。
(3)向过滤Ⅰ的滤液中加入NaClO溶液,将溶液中的Mn2+氧化成MnO2,反应的离子方程式为________________________________。
(4)滤渣Ⅱ中主要成分为________________(填化学式)。
(5)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验操作方法是________________________。
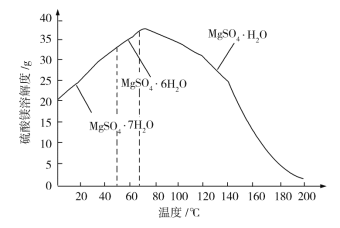
(6)已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从滤液中充分回收MgSO4·H2O,采取将滤液蒸发浓缩、加压升温结晶的方法,采取加压升温结晶的原因是________________________________。
【答案】提高纯橄岩中镁的浸出率 漏斗 Mn2++ClO+H2O![]() MnO2↓+2H++Cl Fe(OH)3、MnO2 取过滤Ⅱ后的滤液1~2 mL于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+ 增大压强,溶液沸点升高,溶液能够达到较高温度,有利于MgSO4·H2O晶体析出
MnO2↓+2H++Cl Fe(OH)3、MnO2 取过滤Ⅱ后的滤液1~2 mL于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+ 增大压强,溶液沸点升高,溶液能够达到较高温度,有利于MgSO4·H2O晶体析出
【解析】
分析流程过程,纯橄岩用硫酸进行酸浸,硅酸盐与硫酸反应生成硫酸盐和硅酸沉淀,MnO、Fe2O3、FeO与硫酸反应生成相应的硫酸盐和水,SiO2不与硫酸反应也不溶于硫酸,以滤渣形式除去,故滤渣Ⅰ的成分可确定。滤液中加入NaClO溶液,可将Fe2+氧化为Fe3+,将Mn2+氧化为MnO2,通过调节pH=5~6,将Fe3+转化为Fe(OH)3沉淀除去。则可知滤渣Ⅱ的成分。据此进行分析。
(1)浸出时升高温度、连续搅拌,其目的是提高纯橄岩中镁的浸出率;答案为:提高纯橄岩中镁的浸出率;
(2)过滤时用到的玻璃仪器是玻璃棒、烧杯和漏斗;答案为:漏斗;
(3)NaClO将溶液中的Mn2+氧化成MnO2,本身被还原为Cl,依据守恒即可写出反应的离子方程式:Mn2++ClO+H2O![]() MnO2↓+2H++Cl;答案为:Mn2++ClO+H2O
MnO2↓+2H++Cl;答案为:Mn2++ClO+H2O![]() MnO2↓+2H++Cl;
MnO2↓+2H++Cl;
(4)加入NaClO溶液,能将Fe2+氧化为Fe3+,将溶液中的Mn2+氧化成MnO2,调节溶液pH=5~6,将Fe3+转化为Fe(OH)3沉淀,滤渣Ⅱ中主要成分为Fe(OH)3、MnO2;答案为:Fe(OH)3、MnO2;
(5)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是用KSCN溶液,具体操作为取过滤Ⅱ后的滤液1~2 mL于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+;答案为:取过滤Ⅱ后的滤液1~2 mL于试管中,加入少量KSCN溶液,如果溶液不显红色,证明滤液中无Fe3+;
(6)从图中可以看出,升高温度,有利于MgSO4·H2O晶体析出,增大压强,溶液的沸点升高,溶液能够达到较高温度,有利于MgSO4·H2O晶体析出。答案为:增大压强,溶液沸点升高,溶液能够达到较高温度,有利于MgSO4·H2O晶体析出。