题目内容
【题目】一定条件下,在水溶液中1mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
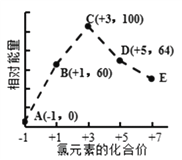
A. 这些离子中结合H+能力最强的是E
B. A、B、C、D、E五种微粒中C最稳定
C. C→B+D,反应物的总键能大于生成物的总键能
D. B→A+D反应的热化学方程式为:3ClO—(aq) == ClO3—(aq) + 2Cl—(aq) △H = -116kJmol-1
【答案】D
【解析】分析:从图示变化看,A为Cl-,B为ClO-,C为ClO2-,D为ClO3—,E为ClO4-;能量越低越稳定,-1价的Cl-能量最低,也最稳定,+3价的ClO2-能量最高,最不稳定;酸性越弱的酸,越容易结合氢离子;根据盖斯定律进行计算C→B+D,2ClO2-→ClO-+ClO3-,△H =64+60-100×2=-76 kJmol-1,该反应放热,据此判断;根据盖斯定律进行计算B→A+D:3ClO—(aq) == ClO3—(aq) + 2Cl—(aq),△H =64-3×60-0=-116kJmol-1,据此判断。
详解:A.酸性越弱的酸,结合氢离子能力越强,次氯酸为最弱的酸,所以ClO-结合氢离子能力最强,A错误;B.根据图像可知氯元素的价态越低,能量最低,最稳定,所以A、B、C、D、E五种微粒中A最稳定,B错误;C.2ClO2-→ClO-+ClO3-,根据盖斯定律可知:△H =64+60-100×2=-76 kJmol-1,该反应为放热反应,反应物的总键能小于生成物的总键能,C错误;3ClO—(aq) == ClO3—(aq) + 2Cl—(aq),根据盖斯定律可知:△H =64-3×60--0=-116kJmol-1,D正确;正确选项D。

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案