��Ŀ����
����Ŀ����ش��������⣺
(1)��֪��N2��O2�����л�ѧ���ļ��ֱܷ���946kJ��mol-1��497 kJ��mol-1.
N2(g)+O2(g)=2NO(g) ��H=+180.0kJ��mol-1������ͬ�������ƻ�1mol NO�����еĻ�ѧ����Ҫ���յ�����Ϊ_______kJ��
(2)25��ʱ��pH=5��CH3COOH��Һ�У���ˮ�������������Ũ��c(H+)=________ kJ��mol-1������Һ�м�������NaOH���壬����Һ��![]() _______(����������������С������������)��д����ʾ�û����Һ����������Ũ��֮���һ����ʽ��_________________��
_______(����������������С������������)��д����ʾ�û����Һ����������Ũ��֮���һ����ʽ��_________________��
(3)25���£���ijNa2CO3��Һ�м���ϡ���ᣬ���к�̼Ԫ�صĸ��������ʵ�������(��)����ҺpH�仯�IJ��������ͼ��ʾ��
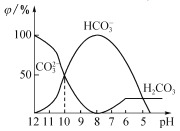
����ͬһ��Һ��,H2CO3��HCO3-��CO32-______(������������������)�������档
�ڵ�pH =7ʱ,��Һ�к�̼Ԫ�ص�����ҪΪ________����Һ�и������ӵ����ʵ���Ũ�ȴ�С��ϵΪ______________��
�۷�Ӧ��CO32-+H2O![]() HCO3-+OH-��ƽ�ⳣ��Kh=______________________��
HCO3-+OH-��ƽ�ⳣ��Kh=______________________��
���𰸡�631.5 10-9 ���� c(CH3COO-)+c(OH-)=c(Na+)+c(H+) ���� HCO3- c(Na+)>c(Cl-)>c(HCO3-)>c(H+)=c(OH-) 10-4
��������
��1���ɼ��������յ�������ȥ�¼������ͷŵ�����ֵ��Ϊ��Ӧ�ȣ�
��2����Һ��pH=-lgc��H+����CH3COOHΪ�ᣬˮ�������c��H+��������Һ��c��OH-��������Һ�м�������NaOH���壬��Ӧ���ɴ����ƣ���Һ��c(CH3COOH)/ c(CH3COO-) c(H+)=1/Ka���¶Ȳ������ƽ�ⳣ�����䣬��Һ�д��ڵ���غ㣻
��3����������20mL0.1mol/L Na2CO3��Һ����μ���0.1mol/L HCl��Һ40mL���ȷ�Ӧ����̼�����ƣ��������ᷴӦ���ɶ�����̼��ˮ��
�ٸ���ͼ2��֪��pH=8ʱֻ��̼��������ӣ�pH����8ʱ����̼������Ӻ�̼������������ӣ�pHС��8ʱ����̼���̼��������ӣ���ͬһ��Һ�У�H2CO3��HCO3-��CO32-���ܹ��棻
��pH=7ʱ����Һ������Ϊ̼�����ơ��Ȼ��Ƽ�̼�ᣬ��Һ�к�̼Ԫ�ص�����ҪΪHCO3-����Һ��ʾ���ԣ�c��H+��=c��OH-�������ݵ���غ��ж���Һ�и�����Ũ�ȴ�С��ϵ��
�۵���Һ��c��HCO3-����c��CO32-��=1��1ʱ��ͼ���֪PH=10��c��H+��=10-10mol/L����Kw��֪c��OH-��=10-4mol/L���ݴ˼���ˮ��ƽ�ⳣ����
��1������N2��O2�����л�ѧ���ļ��ֱܷ���946kJmol-1��497kJmol-1�Լ���ӦN2��g��+O2��g��=2NO��g����H=+180kJmol-1����NO�����л�ѧ���ļ���ΪX�����У�946kJmol-1+497kJmol-1-2X=180kJmol-1�ã�X=631.5kJmol-1���ʴ�Ϊ��631.5��
��2��25��ʱ��pH����5��CH3COOH��Һ��c��H+��=1.0��10-5mol/L��Kw=c��OH-����c��H+��=10-14����Һ�е�c��OH-��= Kw / c��H+��=1.0��10-9mol/L��pH����5��CH3COOH��Һ����������ԴΪ����ĵ����ˮ�ĵ��룬��������Һ��ˮ�������������Ũ�ȵ�������������Ũ�ȣ�������ˮ�������C��H+����1.0��10-9mol/L������Һ�м�������NaOH���壬��Ӧ���ɴ����ƣ���Һ��c(CH3COOH)/ c(CH3COO-) c(H+)=1/Ka���¶Ȳ������ƽ�ⳣ�����䣬��Һ�д��ڵ���غ㣬����Ũ�ȹ�ϵΪ��c��CH3COO-��+c��OH-��=c��Na+��+c��H+�����ʴ�Ϊ��1.0��10-9�����䣻c��CH3COO-��+c��OH-��=c��Na+��+c��H+����
��3����������20mL0.1mol/L Na2CO3��Һ����μ���0.1mol/L HCl��Һ40mL���ȷ�Ӧ����̼�����ƣ��������ᷴӦ���ɶ�����̼��ˮ��
���ɷ�Ӧ��ͼ���֪����ͬһ��Һ�У�H2CO3��HCO3-��CO32-���ܴ������棬�ʴ�Ϊ�����ܣ�
����ͼ���֪��pH=7ʱ��c��OH-��=c��H+������Һ�к�̼Ԫ�ص���Ҫ��ΪHCO3-���ɵ���غ��֪c��Na+��+c��H+��=c��Cl-��+c��HCO3-��+c��OH-������c��Na+��>c��Cl-������HCO3-ˮ�⣬��c��Na+��>c��Cl-��>c��HCO3-��>c��OH-��=c��H+�����ʴ�Ϊ��HCO3-��c��Na+��>c��Cl-��>c��HCO3-��>c��OH-��=c��H+����
��CO32-��ˮ�ⳣ��Kh= c��HCO3-��c��OH-��/ c��CO32-��������Һ��c��HCO3-����c��CO32-��=1��1ʱ��ͼ���֪PH=10����Һ��c��H+��=10-10mol/L����Kw��֪c��OH-��=10-4mol/L����Kh= c��OH-��=10-4mol/L���ʴ�Ϊ��10-4��

����Ŀ��һ���¶��£��������ݻ���Ϊ 1.0 L �ĺ����ܱ������з�����Ӧ��CH3OH(g)+CO(g) CH3COOH(g) ��H<0������˵����ȷ����
������� | �¶�/K | ���ʵ���ʼŨ��/mol/L | ���ʵ�ƽ��Ũ��/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. ��ƽ��ʱ������ I ������ II �е���ѹǿ֮��Ϊ 3 : 4
B. ��ƽ��ʱ������ II �� ![]() ������ I �е�С
������ I �е�С
C. ��ƽ��ʱ���������е�����Ӧ���ʱ����� I �еĴ�
D. ��ƽ��ʱ������ I ��CH3OH ת���������� III �� CH3COOH ת����֮��С�� 1