题目内容
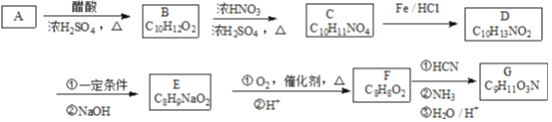
【题目】黄铜矿(CuFeS2)是重要的矿藏,以黄铜矿为原料生产碱式氯化铜和铁红(氧化铁)颜料的工艺流程如图所示。

(1)反应Ⅰ的离子方程式为_____________,该反应的氧化剂是________________。
(2)反应Ⅱ的离子方程式为_________________________。
(3)反应Ⅵ是在45~50℃的条件下进行的,写出该反应的化学方程式:__________________。
(4)碱式氯化铜有多种组成,可表示为Cua(OH)bClc·xH2O,为测定某碱式氯化铜的组成,某实验小组进行下列实验:
①称取样品9.30g,用少量稀HNO3溶解后配成100.00mL溶液A;
②取25.00mL溶液A,加入足量AgNO3溶液,得到AgCl固体1.435g;
③另取25.00mL溶液A,调节pH为4~5,用浓度为0.40mol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,消耗标准溶液50.00mL。通过计算确定该样品的化学式为___________(填化学式)。
【答案】 CuFeS2+3Fe3++Cl-=4Fe2++CuCl+2S FeCl3(或Fe3+) , CuFeS2 Fe2++2HCO3-= FeCO3+H2O+CO2↑ 4 CuCl +O2+8H2O ![]() 2[Cu2(OH)2Cl2·3H2O] Cu2((OH)3Cl·H2O
2[Cu2(OH)2Cl2·3H2O] Cu2((OH)3Cl·H2O
【解析】(1). 由反应流程可知,反应Ⅰ的反应物是CuFeS2和FeCl3,产物有CuCl和S,结合反应II可知,反应I生成的产物有Fe2+,则根据得失电子守恒和原子守恒,反应I的离子方程式为:CuFeS2+3Fe3++Cl-=4Fe2++CuCl+2S,在该反应中,铁元素和铜元素的化合价降低,所以氧化剂是FeCl3(或Fe3+) 、CuFeS2,故答案为:CuFeS2+3Fe3++Cl-=4Fe2++CuCl+2S;FeCl3(或Fe3+) 、CuFeS2;
(2).根据(1)的分析并结合流程图可知,反应Ⅱ中反应物是Fe2+和HCO3-,产物为碳酸亚铁,该反应的离子方程式为: Fe2++2HCO3-= FeCO3+H2O+CO2↑,故答案为: Fe2++2HCO3-= FeCO3+H2O+CO2↑;
(3).反应Ⅵ是在45~50 ℃的条件下进行的,根据流程图可知,该反应的反应物是CuCl、H2O和O2,产物是Cu2(OH)2Cl2·3H2O,在该反应中,铜元素的化合价升高,CuCl是还原剂,O2是氧化剂,则根据得失电子守恒和原子守恒,反应VI的化学方程式为:4 CuCl +O2+8H2O ![]() 2[Cu2(OH)2Cl2·3H2O],故答案为:4 CuCl +O2+8H2O
2[Cu2(OH)2Cl2·3H2O],故答案为:4 CuCl +O2+8H2O ![]() 2[Cu2(OH)2Cl2·3H2O];
2[Cu2(OH)2Cl2·3H2O];
(4).由实验②可求出:n(Cl)=n(AgCl)×![]() =
=![]() ×
×![]() =0.04mol,由实验③并结合反应Cu2++H2Y2-=CuY2-+2H+可求出:n(Cu2+)=n(EDTA)×
=0.04mol,由实验③并结合反应Cu2++H2Y2-=CuY2-+2H+可求出:n(Cu2+)=n(EDTA)×![]() =0.40mol·L-1×0.05000 L×
=0.40mol·L-1×0.05000 L×![]() =0.08 mol,根据化合物中电荷守恒得:n(OH)=2n(Cu2+)n(Cl)=2×0.08mol0.04 mol=0.12 mol,则m(Cl)=0.04 mol×35.5 g/mol=1.42 g,m(Cu2+)=0.08 mol×64 g/mol=5.12 g,m(OH)=0.12 mol×17 g/mol=2.04 g,所以n(H2O)=(9.30g1.42g5.12g2.04g)÷18g/mol=0.04 mol,则a:b:c:x=n(Cu2+):n(OH):n(Cl):n(H2O)=2:3:1:1,即化学式为Cu2((OH)3Cl·H2O,故答案为:Cu2((OH)3Cl·H2O。
=0.08 mol,根据化合物中电荷守恒得:n(OH)=2n(Cu2+)n(Cl)=2×0.08mol0.04 mol=0.12 mol,则m(Cl)=0.04 mol×35.5 g/mol=1.42 g,m(Cu2+)=0.08 mol×64 g/mol=5.12 g,m(OH)=0.12 mol×17 g/mol=2.04 g,所以n(H2O)=(9.30g1.42g5.12g2.04g)÷18g/mol=0.04 mol,则a:b:c:x=n(Cu2+):n(OH):n(Cl):n(H2O)=2:3:1:1,即化学式为Cu2((OH)3Cl·H2O,故答案为:Cu2((OH)3Cl·H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案