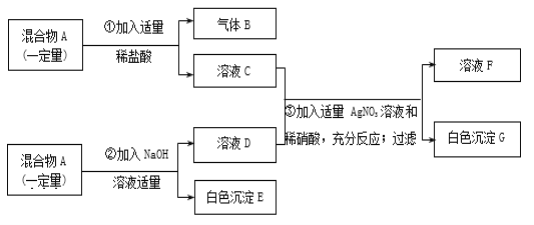
题目内容
【题目】一定温度下,在三个容积均为 1.0 L 的恒容密闭容器中发生反应:CH3OH(g)+CO(g) CH3COOH(g) ΔH<0。下列说法正确的是
容器编号 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | ||
c(CH3OH) | c(CO) | c(CH3COOH) | c(CH3COOH) | ||
I | 530 | 0.50 | 0.50 | 0 | 0.40 |
II | 530 | 0.20 | 0.20 | 0.40 | |
III | 510 | 0 | 0 | 0.50 | |
A. 达平衡时,容器 I 与容器 II 中的总压强之比为 3 : 4
B. 达平衡时,容器 II 中 ![]() 比容器 I 中的小
比容器 I 中的小
C. 达平衡时,容器Ⅲ中的正反应速率比容器 I 中的大
D. 达平衡时,容器 I 中CH3OH 转化率与容器 III 中 CH3COOH 转化率之和小于 1
【答案】D
【解析】
A.根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,容器I中平衡时浓度之和为0.4+0.1+0.1=0.6( mol/L),因此达平衡时,容器II中平衡时浓度之和小于0.6 mol/L×1.2=0.72 mol/L,容器I与容器II中的总压强之比大于0.6:0.72=5:6>3:4,故A错误;
CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,容器I中平衡时浓度之和为0.4+0.1+0.1=0.6( mol/L),因此达平衡时,容器II中平衡时浓度之和小于0.6 mol/L×1.2=0.72 mol/L,容器I与容器II中的总压强之比大于0.6:0.72=5:6>3:4,故A错误;
B.根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,则
CH3COOH(g)可知容器II中的起始量为相同条件容器I中的1.2倍,相当于增大压强的结果,增大压强,平衡正向移动,则![]() 增大,则达平衡时,容器II中
增大,则达平衡时,容器II中![]() 比容器I中的大,故B错误;
比容器I中的大,故B错误;
C.根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效,但容器Ⅲ中的温度低,温度越低,反应速率越慢,因此达平衡时,容器Ⅲ中的正反应速率比容器I中的小,故C错误;
CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效,但容器Ⅲ中的温度低,温度越低,反应速率越慢,因此达平衡时,容器Ⅲ中的正反应速率比容器I中的小,故C错误;
D. 根据CH3OH(g)+CO(g) ![]() CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效;该反应为放热反应,降低温度,平衡正向移动,CH3COOH的转化率减小,因此达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1,故D正确;
CH3COOH(g)可知,容器I中起始量与容器Ⅲ等效;该反应为放热反应,降低温度,平衡正向移动,CH3COOH的转化率减小,因此达平衡时,容器I中CH3OH转化率与容器III中CH3COOH转化率之和小于1,故D正确;
答案选D。