题目内容
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g) PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
| | PCl3(g) | Cl2(g) | PCl5(g) |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
A.10 min内,v(Cl2) =" 0.04" mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的
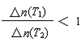
D.平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L
C
解析试题分析: PCl3(g) + Cl2(g)  PCl5(g)
PCl5(g)
起始浓度: 2.0 1.0 0
转化: 0.4 0.4 0.4
平衡浓度: 1.6 0.6 0.4
A、10 min内,v(Cl2) =" 0.04" mol/(L·min),正确;B、当容器中Cl2为1.2 mol时,此时Cl2浓度为0.6 mol/L。反应达到平衡,正确;C、若升高温度(T1<T2)时,该反应平衡常数减小,表明该反应正向为放热反应,高温时PCl3的浓度改变量小,则平衡时PCl3的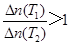 ,正确;D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L,正确。
,正确;D、平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L,正确。
考点:电解质的有关知识。

对于反应3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
Fe3O4(s)+4H2(g)的平衡常数,下列说法正确的是
A.K=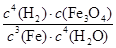 |
B.K=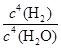 |
| C.增大c(H2O)或减小c(H2),会使该反应平衡常数减小 |
| D.改变反应的温度,平衡常数不一定变化 |
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:
aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则 ( )
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则 ( )
| A.a=3 | B.a=2 | C.B的转化率为40% | D.B的转化率为60% |
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g) MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+SO2(g)+ CO2(g) ΔH>0,该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
某学习小组为了探究 BrO3-+5Br-+6H+=3Br2 +3H2O 反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:zxxk
 实验编号 实验编号相关数据 | ① | ② | ③ | ④ | ⑤ |
| c(H+)/ mol · L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
| c(BrO3-)/ mol· L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
| c(Br-)/ mol· L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
| v / mol· L-1· s-1 | 2.4×10-8 | 4.8×10-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论不正确的是
A.若温度升高到40℃,则反应速率增大
B.实验②、④,探究的是c(BrO3-)对反应速率的影响
C.若该反应速率方程为v ="k" ca(BrO3-)cb(Br-)cc(H+)(k为常数),则c =2
D.实验⑤中,v1 =4.8×10-8 mol· L-1· s-1
已知反应X (g)+Y (g)  n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是
n Z (g) △H > 0,将X和Y以一定比例混合通入密闭容器中进行反应,各物质的浓度随时间的改变如图所示。下列说法不正确的是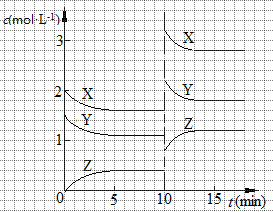
| A.反应方程式中n=1 |
| B.10 min时,曲线发生变化的原因是升高温度 |
| C.10 min时,曲线发生变化的原因是增大压强 |
| D.0~5 min内,用X表示的反应速率为v(X)="0.08" mol·L-1·min-1 |
决定化学反应速率的主要因素是
| A.反应物的浓度 | B.反应温度 | C.使用催化剂 | D.反应物的性质 |
 xC(g)(正反应为放热反应)。测得两容器中C(A)随时间t的变化如图所示:下列说法正确的是 ( )
xC(g)(正反应为放热反应)。测得两容器中C(A)随时间t的变化如图所示:下列说法正确的是 ( )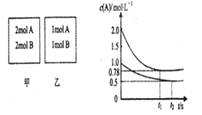
 2Q(g)+ nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是
2Q(g)+ nR(g)达到平衡时测得 X的转化率为25%,此时混合气体的体积为6.5L。则该反应方程式中的n值是