题目内容
某温度下,将2 mol A和3 mol B充入一密闭容器中,发生反应:
aA(g)+B(g) C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则 ( )
C(g)+D(g),5 min后达到平衡.已知该温度下其平衡常数K=1,若温度不变时将容器的体积扩大为原来的10倍,A的转化率不发生变化,则 ( )
| A.a=3 | B.a=2 | C.B的转化率为40% | D.B的转化率为60% |
C
解析试题分析:若在温度不变的情况下,将容器的容积扩大为原来的10倍,A的转化率不发生变化—— 温度不变K,转化率不变说明平衡不移动;故增大体积反应物浓度与生成物浓度同时降低,然而平衡不移动说明反应前后气体的反应系数之和相同,即a+1=1+1,故a=1。
设生成C xmol
A + B → C + D
起始时 2 3 0 0
转化量 x x x x
平衡时 2-x 3-x x x
根据平衡常数 K=c(C)·c(D)÷[c(A)·c(B)]=1
即 (2-x)(3-x)=x2 解得: x=1.2mol
故B得转化率为 x÷3×100%=40%
考点:考查了化学平衡移动和计算。

将2.0molPCl3,和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
PCl5(g)达到平衡时,PCl5为0.40mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是
| A.0.40mol | B.小于0.20mol | C.0.20mol | D.大于0.20mol,小于0.40mol |
在恒温、容积为2 L的密闭容器中充入2 mol SO2和一定量O2。发生反应2SO2+O2? ?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
?2SO3,当反应进行到4 min时,测得n (SO2)=0.4 mol。若反应进行到2 min时,容器中SO2的物质的量是( )
| A.等于1.6 mol | B.等于1.2 mol |
| C.大于1.6 mol | D.小于1.2 mol |
温度为500℃时,反应4NH3+5O2 4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
4NO+6H2O在2L的密闭容器中进行,半分钟后NO的物质的量增加了0.3mol,则此反应的平均速率v (x)为( )
| A.v(O2)=0.01mol/(L?s) | B.v(NO)=0.01mol/(L?s) |
| C.v(H2O)=0.006mol/(L?s) | D.v(NH3)=0.005mol/(L?s) |
常温常压下,注射器甲中装有NO2气体,注射器乙中装有相同体积的空气,注射器与U 形管连通,如图所示,打开两个止水夹,同时向外拉两注射器的活塞,且拉动的距离相等,将会看到U形管中液面(不考虑此条件下NO2与水的反应)( )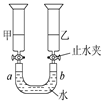
| A.a端上升,b端下降 | B.a端下降,b端上升 |
| C.U形管中液面无变化 | D.无法判断 |
图中表示外界条件(T、p)的变化对下列反应的影响:L(s)+G(g) 2R(g)△H>0,y 轴表示的是
2R(g)△H>0,y 轴表示的是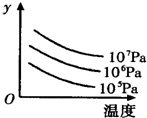
| A.平衡时,混合气中R的百分含量 | B.G的转化率 |
| C.平衡时,混合气中G的百分含量 | D.L的转化率 |
PCl3和PCl5都是重要的化工原料。将PCl3(g)和Cl2(g)充入体积不变的2 L密闭容器中,在一定条件下发生下述反应,10 min时达到平衡:PCl3(g) + Cl2(g) PCl5(g)有关数据如下,下列判断不正确的是
PCl5(g)有关数据如下,下列判断不正确的是
| | PCl3(g) | Cl2(g) | PCl5(g) |
| 初始浓度(mol/L) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol/L) | c1 | c2 | 0.4 |
A.10 min内,v(Cl2) =" 0.04" mol/(L·min)
B.当容器中Cl2为1.2 mol时,反应达到平衡
C.若升高温度(T1<T2)时,该反应平衡常数减小,则平衡时PCl3的
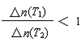
D.平衡后移走2.0 mol PCl3和1.0 molCl2,在相同条件下再达平衡时,c(PCl5)<0.2 mol/L