��Ŀ����
����Ŀ��ij��ѧС��������װ����ȡ�ռ����������������о������ʡ���ش��������⡣

(1)װ�ü�������A��������_____________������Ӧװ����Һ��________________����װ���з�����Ӧ�����ӷ���ʽΪ__________________________________________________����ȡ�ռ�����������װ�ýӿ�����˳����a�� _____________��g(��������)��
(2)�Ʊ���Ӧ��������Ũ���½���ֹͣ��Ϊ�ⶨ��Ӧ����Һ�������Ũ�ȣ�̽��С��ͬѧ�������ʵ�鷽����
I������������AgNO3��Һ��Ӧ���������ɵ�AgCl������
������������к͵ζ����ⶨ��
��������֪��CaCO3(����)��Ӧ������ʣ���CaCO3������
�̶����������жϺ�ʵ�飺
���ж�I���������У�������____________��
�ڽ��Т�ʵ�飺ȷ��ȡ������Һϡ��һ����������Ϊ������
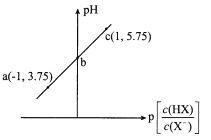
a.��ȡ����20.00mL����ƿ�У�����ƿ�д�������ˮ����ʵ�����Ƿ���Ӱ�죿_____������������������)��0.10 molL-1NaOH����Һ�ζ�������NaOH����Һ�������ͼ��ʾ�������Ϊ_____ mL��

b��ƽ�еζ�����ʵ������
���жϢ���ʵ����___________(����ƫ��������ƫС������ȷ��)��[��֪��Ksp(CaCO3)��2.8��10-9��Ksp(MnCO3)��2.3��10-11
(3)ijͬѧ��Ϊ���������������Ե�ȱ�ݣ���ָ��_______________________________��
���𰸡���Һ©�� ����NaCl��Һ MnO2��4H++2Cl-![]() Mn2+��Cl2����2H2O debcf ����Һ�е�MnCl2 Ҳ����AgNO3��Ӧ�γɳ��� �� 22.60 ƫС û��β������װ��
Mn2+��Cl2����2H2O debcf ����Һ�е�MnCl2 Ҳ����AgNO3��Ӧ�γɳ��� �� 22.60 ƫС û��β������װ��
��������
��1����Ϥ������������״��˵�������ƣ�����������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ��Ũ�����ӷ����Ʊ������������Ȼ��⣬����Ȼ��⡢�����ڱ���ʳ��ˮ���ܽ���ص�ѡ����ʵij��Ӽ���������װ�����ý�������
��2���٢�������������Ũ���ᷴӦ�����Ȼ��̣��Ȼ���Ҳ������������Ӧ��
�ڢ�����ƿ�к�����ˮ����Ӱ�����������ʵ���������ͼ����ȡ���ݣ�
�ۢ�������֪��CaCO3����������Ӧ������ʣ���CaCO3���������ڲ���̼���ת����̼���̳���������ʣ��Ĺ���������ƫ��
��3�������ж���ֱ���ŷ��ܹ�������Ⱦ��
��1��װ�ü�������A������Ϊ��Һ©��������������Ũ�����ڼ��������·�Ӧ�����Ȼ��̡�������ˮ�����ӷ���ʽΪMnO2��4H++2Cl-![]() Mn2+��Cl2����2H2O����װ��������ȡ������AΪ��Һ©�������μ�Ũ����Ӽ�װ�ó��������庬�Ȼ����ˮ������Ũ���������ˮ�ԣ�װ������Ũ��������ø����������Ȼ���������ˮ�������ڱ���ʳ��ˮ���ܽ�Ⱥ�С������װ�ñ��п���ʢ�ű���ʳ��ˮ��ȥ�����е��Ȼ��⣬��������ͨ���������ȳ��Ӻ��������ܶȱȿ����ܶȴ��������������ռ��������̳�������ȷ��˳��Ϊ��a��d��e��b��c��f��g���ʴ�Ϊ����Һ©��������NaCl��Һ��MnO2+4H++2Cl=Mn2++Cl2��+2H2O�� debcf��
Mn2+��Cl2����2H2O����װ��������ȡ������AΪ��Һ©�������μ�Ũ����Ӽ�װ�ó��������庬�Ȼ����ˮ������Ũ���������ˮ�ԣ�װ������Ũ��������ø����������Ȼ���������ˮ�������ڱ���ʳ��ˮ���ܽ�Ⱥ�С������װ�ñ��п���ʢ�ű���ʳ��ˮ��ȥ�����е��Ȼ��⣬��������ͨ���������ȳ��Ӻ��������ܶȱȿ����ܶȴ��������������ռ��������̳�������ȷ��˳��Ϊ��a��d��e��b��c��f��g���ʴ�Ϊ����Һ©��������NaCl��Һ��MnO2+4H++2Cl=Mn2++Cl2��+2H2O�� debcf��
��2���٢������С���Ӧ����Һ�е��������������Ӧ�����Ȼ����������������̺�Ũ���ᷴӦ���ɵ��Ȼ���Ҳ������������Ӧ�����Ȼ����������ʳ������ɵ�AgCl������ֻ����������ӵ����ʵ��������������ʣ�������Ũ�ȡ���С���Ϊ������Һ�е�MnCl2Ҳ����AgNO3��Ӧ�γɳ�����
�ڢ�����ƿ�к�����ˮ����Ӱ�����������ʵ���������ͼ����ȡ����Ϊ��22.60mL����С���Ϊ������22.60��
�ۢ�������Ksp��CaCO3��=2.8��10-9 ��Ksp(MnCO3)��2.3��10-11֪��̼���̵�Ksp��̼���С�����ڲ���̼���ת����̼���̳���������ʣ��Ĺ���������ƫ����ʵ����ƫС����С���Ϊ��ƫС��
��3�������ж�ֱ���ŷŻ���Ⱦ������������ȱ��β������װ�á���С���Ϊ��û��β������װ�á�