题目内容
【题目】20世纪50年代科学家提出价层电子对互斥模型(简称VSEPR模型),用于预测简单分子立体结构.其要点可以概括为:
Ⅰ、用AXnEm表示只含一个中心原子的分子,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤对电子),(n+m)称为价层电子对数.分子中的价层电子对总是互相排斥,均匀的分布在中心原子周围的空间;
Ⅱ、分子的立体构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤对电子;
Ⅲ、分子中价层电子对之间的斥力的主要顺序为:
i、孤对电子之间的斥力>孤对电子对与共用电子对之间的斥力>共用电子对之间的斥力;
ii、双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;
iii、X原子得电子能力越弱,A﹣X形成的共用电子对之间的斥力越强;
iv、其他.
请仔细阅读上述材料,回答下列问题:
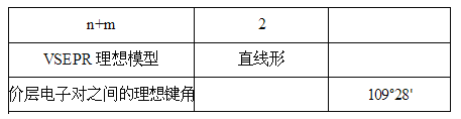
(1)根据要点I可以画出AXnEm的VSEPR理想模型,请填写下表__:
(2)H2O分子的立体构型为:__,请你预测水分子中∠H﹣O﹣H的大小范围__;
(3)SO2Cl2和SO2F2都属AX4E0型分子,S=O之间以双键结合,S﹣Cl、S﹣F之间以单键结合.请你预测SO2Cl2和SO2F2分子的立体构型:__,SO2Cl2分子中∠Cl﹣S﹣Cl__(选填“<”、“>”或“=”)SO2F2分子中∠F﹣S﹣F。
(4)用价层电子对互斥理论(VSEPR)判断SO32﹣离子的空间构型:__。
【答案】 V形 ∠H﹣O﹣H<109°28′ 四面体 > 三角锥形
V形 ∠H﹣O﹣H<109°28′ 四面体 > 三角锥形
【解析】
(1)当n+m=4时,VSEPR模型为四面体形,当n+m=2时,VSEPR模型为直线形;
(2)根据H2O属AX2E2, n+m=4,VSEPR模型为四面体形,但氧原子有2对孤电子对来判断分子的立体构型;水分子属AX2E2, n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′,根据Ⅲ-i来判断键角;
(3)当n+m=4时,VSEPR模型为四面体形,硫原子无孤电子对来判断分子的立体构型;X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;
(4)根据价层电子对互斥理论确定亚硫酸根离子空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=1/2(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数。
(1)当n+m=4时,VSEPR模型为四面体形,其键角是109°28′,当n+m=2时,VSEPR模型为直线形,其键角是180°;
因此,本题正确答案是:

(2)H2O属AX2E2, n+m=4,VSEPR模型为四面体形,但氧原子有2对孤电子对,所以分子的构型为V形;水分子属AX2E2, n+m=4,VSEPR理想模型为正四面体,价层电子对之间的夹角均为109°28′,根据Ⅲ-i,应有∠H﹣O﹣H<109°28′;
因此,本题正确答案是:V形;∠H﹣O﹣H<109°28′。
(3)当n+m=4时,VSEPR模型为四面体形,硫原子无孤电子对,所以分子构型为四面体,F原子的得电子能力大于氯原子,因为X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强,所以SO2Cl2分子中∠Cl﹣S﹣Cl> SO2F2 分子中∠F﹣S﹣F ;
因此,本题正确答案是:四面体;>。
(4)该离子中价层电子对个数=3+1/2(6+2-3×2)=4,且含有一个孤电子对,所以VSEPR理想模型是四面体形,立体构型是三角锥形;
因此,本题正确答案是:三角锥形。