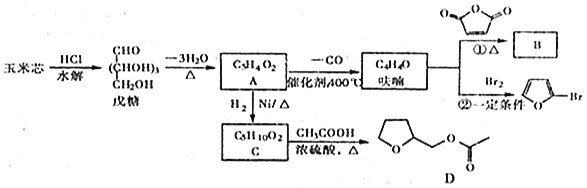
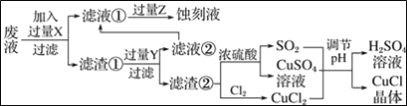
题目内容
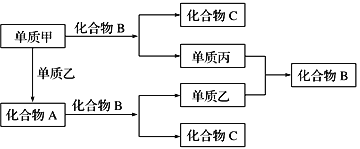
【题目】A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,这些单质和化合物之间存在如图所示的关系,完成下列空白:
(1)向酚酞试液中加入化合物A的粉末,现象为________。
(2)单质甲与化合物B反应的离子方程式为__________。5.05g单质甲—钾合金溶于200mL水生成0.075mol氢气,确定该合金的化学式为______ 。
(3)向一定体积某浓度的化合物C的溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同。若向M中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示两种情况。
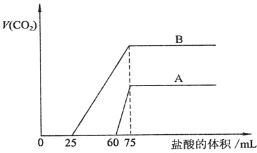
①由A确定滴加前60mL的盐酸时,发生反应的离子方程式为_____________________
②B对应的溶液M低温蒸干后得到固体a克,将a克固体充分加热至恒重后,固体质量减少 _____ 克。
③由A、B可知,两次实验通入的CO2的体积比为___________
【答案】溶液先变红,后褪色,并有气泡2Na+2H2O==2Na++2OH-+H2↑NaK2H+ +OH—==H2O、H++CO32-=HCO3-0.07753:10
【解析】
A、B、C是由周期表中短周期元素组成的三种常见化合物,甲、乙、丙是三种单质,甲与B反应是置换反应,甲与乙是化合反应,丙与乙也是化合反应,单质甲、含有甲元素的化合物A均与化合物B反应得到不同的单质,且两种单质反应又得到化合物B,应是Na、过氧化钠与水的反应,可推知甲是Na单质,乙为氧气,B是H2O,丙为氢气,C是NaOH,A是Na2O2。据此分析可得结论。
(1)向酚酞试液中加入化合物Na2O2的粉末,过氧化钠与水反应生成氢氧化钠与氧气,氢氧化钠使酚酞溶液变红色,但过氧化钠具有漂白性,则现象为:溶液先变红后褪色,并有气泡生成;
(2)单质甲与化合物B反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,根据电子转移守恒可知,Na、K总物质的量为0.075mol×2=0.15mol,设Na、K物质的量分别为xmol、ymol,则:x+y=0.15mol,23g/molx+39g/moly=5.05g,解得x=0.05、y=0.1,故合金的化学式为NaK2;故答案为:2Na+2H2O=2Na++2OH-+H2↑、NaK2;
(3)①曲线A、B,开始没有气体,加入一定体积盐酸后生成气体,生成气体的反应为:HCO3-+H+=H2O+CO2↑,若A中只有Na2CO3,开始发生CO32-+H+=HCO3-,前后两过程消耗HCl的体积相等,实际开始阶段消耗盐酸体积大于产生二氧化碳消耗的盐酸体积,故A曲线表明M中的溶质为NaOH、Na2CO3,则滴加前60mL的盐酸时,发生反应的离子方程式为:H+ +OH—==H2O、H++CO32-=HCO3-;
②B曲线中,前后消耗盐酸的体积之比为1:2,则曲线B表明M中溶质为Na2CO3、NaHCO3,且二者物质的量之比为1:1,设n(Na2CO3)= n(NaHCO3)=x,由钠离子守恒可得:2x+x=0.1mol/L×0.075L=0.0075mol,x=0.0025mol,固体加热时发生反应:2NaHCO3![]() Na2CO3+H2O↑+CO2↑,则减少的质量为生成的水和二氧化碳的质量,其质量为:0.0025mol÷2×62g/mol=0.0775g,故答案为:0.0775;
Na2CO3+H2O↑+CO2↑,则减少的质量为生成的水和二氧化碳的质量,其质量为:0.0025mol÷2×62g/mol=0.0775g,故答案为:0.0775;
③曲线A生成二氧化碳消耗盐酸体积为(75-60)mL=15mL,曲线B生成二氧化碳消耗盐酸体积为(75-25)mL=50mL,由HCO3-+H+=H2O+CO2↑可知,则两次实验通入的CO2的体积之比=15mL:50mL=3:10;故答案为:3:10;

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案