��Ŀ����
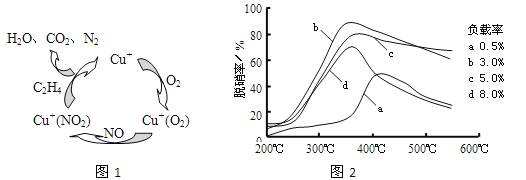
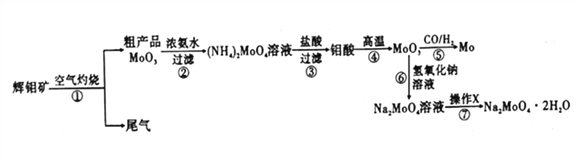
����Ŀ������һ����Ҫ�Ĺ��ɽ���Ԫ�أ�ͨ�������Ͻ���ֵ����Ӽ�������ǿ�Ͻ��ǿ�ȡ�Ӳ�ȡ��ɺ��Եȡ������ƾ���(Na2MoO4��2H2O)����Ϊ��������ȴˮϵͳ�Ľ�����ʴ���Ƽ�����ͼ15�ǻ����������Ի����(��Ҫ�ɷ�Ϊ����MoS2)Ϊԭ�����Ʊ������⡢�����ƾ������Ҫ����ͼ��
�ش���������:
��1����֪��Ӧ��Ϊ���ֽⷴӦ����������Կ�Ļ��ϼ�Ϊ___________��
��2����Ӧ�������ӷ���ʽΪ___________��
��3�����������ʱ�Ļ�ѧ����ʽΪ____________��
��4������XΪ_________����֪��������һ���¶ȷ�Χ�ڵ��������ʼ���Ӧ���ʵ��ܽ�����±���ʾ�����ڲ���X��Ӧ�����¶ȵ���ѷ�ΧΪ_______(�����)��
�¶�(��) | 0 | 4 | 9 | 10 | 15.5 | 32 | 51.5 | 100 | >100 |
�������� | Na2MoO4��10H2O | Na2MoO4��2H2O | Na2MoO4 | ||||||
�ܽ�� | 30.63 | 33.85 | 38.16 | 39.28 | 39.27 | 39.82 | 41.27 | 45.57 | |
A.0�桫10�� B.10�桫100�� C.15.5�桫50�� D.100������
��5���Ʊ������ƾ��廹����ͨ�����ƵĻ������ֱ�Ӽ������������Һ�����ķ����������������У��������������ɣ����������뻹ԭ�������ʵ���֮��Ϊ_________��
��6��Li��MoS2�ɳ���صĹ���ԭ��ΪxLi+nMoS2![]() Lix(MoS2)n[Lix(MoS2)n�����ڵ缫��]�����س��ʱ�����ĵ缫��ӦʽΪ___________________��
Lix(MoS2)n[Lix(MoS2)n�����ڵ缫��]�����س��ʱ�����ĵ缫��ӦʽΪ___________________��
��7�����û�ԭ������(CO��H2)��ԭMoO3���⣬ҵ���Ʊ���ԭ������CO��H2�ķ�Ӧԭ��֮һΪCO2+CH4![]() 2CO+2H2���������������Ϊ90%��7L(��״��)��Ȼ��������������̼�ڸ����·�Ӧ������ת����Ϊ80%,�ò�����CO��H2��ԭMoO3���⣬�������������������Ϊ_________��
2CO+2H2���������������Ϊ90%��7L(��״��)��Ȼ��������������̼�ڸ����·�Ӧ������ת����Ϊ80%,�ò�����CO��H2��ԭMoO3���⣬�������������������Ϊ_________��
���𰸡� +6 MoO3+2OH=![]() +
+![]() 2MoS2+7O2
2MoS2+7O2![]() 2MoO3+4SO2 ����Ũ������ȴ�ᾧ C 9�U1 Lix(MoS2)n xe = nMoS2 +xLi+ 28.8g
2MoO3+4SO2 ����Ũ������ȴ�ᾧ C 9�U1 Lix(MoS2)n xe = nMoS2 +xLi+ 28.8g
����������1����������炙�ѧʽ��֪����Ԫ�ػ��ϼ�Ϊ+6�ۣ����ڷ�Ӧ��Ϊ���ֽⷴӦ������������Ļ��ϼ�Ϊ+6������ȷ����+6��
��2������������ǿ����Һ��Ӧ����Na2MoO4��ˮ����Ӧ�����ӷ���ʽΪMoO3+2OH=![]() +
+![]() ����ȷ����. MoO3+2OH=
����ȷ����. MoO3+2OH=![]() +
+![]() ��
��
��3����������ͼ���������������������������MoO3����ѧ����ʽΪ2MoS2+7O2![]() 2MoO3+4SO2 ����ȷ����2MoS2+7O2
2MoO3+4SO2 ����ȷ����2MoS2+7O2![]() 2MoO3+4SO2��
2MoO3+4SO2��
��4����Na2MoO4��Һ��ΪNa2MoO42H2O���壬��Ҫ���е�����Ũ������ȴ�ᾧ�����ݱ������ݿ�֪Ҫ�γ�Na2MoO42H2O���壬15.5�桫50�� ��Χ�������C��ȷ��.��ȷ��������Ũ������ȴ�ᾧ��C��
��5������������������������ԭΪ�Ȼ��ƣ��������MoS2����ԭ����������ΪNa2MoO4����������ӣ������������xmol��MoS2 ymol�����ݵ����غ������x����1-��-1����=y����6-4+{6-��-2��}��2����x��y=9:1����ȷ�𰸣�9:1��
��6���ŵ�Ϊԭ��������Ϊ���أ�������������������Ӧ��Lix(MoS2)nʧ���ӱ�ΪMoS2���缫��ӦʽΪ Lix(MoS2)n xe = nMoS2 +xLi+ ����ȷ����Lix(MoS2)n xe = nMoS2 +xLi+ ��
��7������CO2��CH4![]() 2CO��2H2��1����ļ��鷢����Ӧ����4����Ļ�ԭ�����������������Ϊ7��90%��80%��4=20.16L������1molMo����3molCO��H2����������n(Mo)= 20.16/��22.4��3��=0.3mol���������Ϊm(Mo)= 0.3��96=28.8 g����ȷ�𰸣�28.8 g��
2CO��2H2��1����ļ��鷢����Ӧ����4����Ļ�ԭ�����������������Ϊ7��90%��80%��4=20.16L������1molMo����3molCO��H2����������n(Mo)= 20.16/��22.4��3��=0.3mol���������Ϊm(Mo)= 0.3��96=28.8 g����ȷ�𰸣�28.8 g��

����Ŀ��ij�¶��£���ӦH2��g��+CO2��g��H2O��g��+CO��g����ƽ�ⳣ��K= ![]() �����¶����������Ϊ10L�������ܱ������зֱ���뷴Ӧ���ʼ��������ͼ��ʾ�������жϲ���ȷ���ǣ�������
�����¶����������Ϊ10L�������ܱ������зֱ���뷴Ӧ���ʼ��������ͼ��ʾ�������жϲ���ȷ���ǣ�������
��ʼ�� | �� | �� | �� |
H2 ��mol�� | 1 | 2 | 2 |
CO2��mol�� | 1 | 1 | 2 |
A.��Ӧ��ʼʱ�����еķ�Ӧ�������������еķ�Ӧ�������
B.ƽ��ʱ���ͱ���CO2��ת������ȣ�����60%
C.ƽ��ʱ������H2��ת���ʴ���60%
D.ƽ��ʱ������c��H2����0.08 molL��1