题目内容
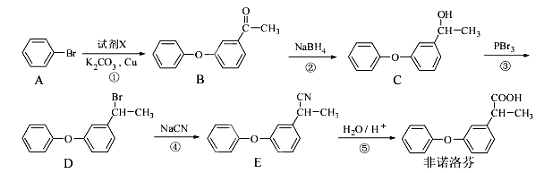
【题目】草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO2、MgO、CaO等]制取草酸钴晶体(CoC2O42H2O)工艺流程如图:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的PH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的离子方程式为________________________
(2)NaClO3的作用是_________________调PH至5.2,沉淀的主要成分为__________

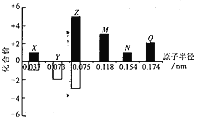
(3)萃取剂对金属离子的萃取率与pH的关系如图2所示。滤液Ⅱ中加入萃取剂的作用是___________________;使用萃取剂适宜的pH是_______________
A. 接近2.0 B.接近3.0 C.接近5.0
(4)除钙、镁是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀,已知Ksp(MgF2)=7.35×1011、Ksp(CaF2)=1.05×1010.当加入过量NaF后,所得滤液c(Mg2+):c(Ca2+)=________________.
(5)已知含钴废料中含Co2O3质量分数为a%,若取mkg该含钴废料按照上述流程,理论上最多能制得草酸钴晶体的质量为_________________g
【答案】 2Co3++SO32-+ H2O= 2Co2++SO42-+2H+ 将 Fe2+氧化为 Fe3+ Al(OH)3、Fe(OH)3 除去Mn2+ B 0.7 1830ma/83 或 16.6ma
【解析】(1)浸出过程中加入Na2SO3的目的是将Co3+、Fe3+还原为Co2+、Fe2+,其中的一个反应离子方程式为2Co3++SO32-+ H2O= 2Co2++SO42-+2H+ ;
(2)NaClO3的作用是:将浸出液中Fe2+氧化为Fe3+,
故答案为:将浸出液中Fe2+氧化为Fe3+;加Na2CO3调PH=5.2能使Fe3+、Al3+ 离子转化成氢氧化物沉淀,沉淀的主要成分为Al(OH)3、Fe(OH)3 ;
(3)滤液中加入萃取剂的作用是除去锰离子;pH=2与pH=3时Co2+的萃取率变化不大,但pH=3时Mn2+的萃取率增大很多,而pH=4时,Co2+的萃取率比较大,故pH=3时最佳,;
(4)由溶度积可知,滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为CaF2、MgF2沉淀,根据溶度积可知c(Mg2+):c(Ca2+)=![]() =0.7;
=0.7;
(5)mkg该含钴废料中含Co2O3的物质的量为![]() =
=![]() mol,根据原子守恒则草酸钴晶体的物质的量为
mol,根据原子守恒则草酸钴晶体的物质的量为![]() mol×2=
mol×2=![]() mol,理论上最多能制得草酸钴晶体的质量为
mol,理论上最多能制得草酸钴晶体的质量为![]() mol×183g/mol=16.6mag。
mol×183g/mol=16.6mag。

 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案【题目】如图所示的甲、乙两个装置,均挤压胶头滴管,一段时间后两装置中的气球都明显胀大(忽略液体体积气球体积的影响),则滴管和烧瓶中所有试剂可能是( )
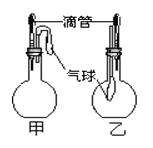
选项 | 甲 | 乙 | ||
滴管 | 烧瓶 | 滴管 | 烧瓶 | |
A | 浓硫酸 | Fe | NaOH溶液 | SO2气休 |
B | 双氧水 | MnO2 | AgNO3溶液 | HCl气体 |
C | 浓硝酸 | Al | H2O | 氨气 |
D | 氨水 | CaO | 稀盐酸 | NaCO3 |
A. A B. B C. C D. D