题目内容
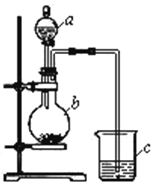
【题目】50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。回答下列问题:
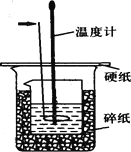
(1)箭头所指仪器的名称是 。作用是 。
(2)实验所用的NaOH溶液体积与盐酸相同,但浓度却比盐酸大的原因是 。
(3)用相同浓度和体积的醋酸代替HCl溶液进行上述实验,放出的热量会 。(填“偏大”“偏小”或“无影响”)。测得的△H会 (填“偏大”“偏小”或“无影响”)。
(4)上图所示实验装置存在着一处错误,这处错误是 。
(5)实验测得中和热△H =" -" 57.3 kJ·mol–1若忽略能量的损失,请你计算出实验前后温度的差值△t (保留一位小数,水的比热容c=4.18J/(g·℃)两种溶液的密度近似取1g/ml )
【答案】(1)环形玻璃搅拌棒 搅拌充分反应;(2)保证酸完全反应 ; (3)偏小 偏大;(4)大烧杯与小烧杯未相平 散热量大;(5)3.4℃
【解析】试题分析:(1)测中和热的试验中用到的搅拌工具是环形玻璃搅拌棒,主要作用是搅拌是酸和碱充分反应,答案为:环形玻璃搅拌棒 搅拌充分反应;(2)中和热是指强酸和强碱在稀溶液中生成1mol水时放出的热量,实验中要保证生成0.025mol的水,必须酸是反应完全了的,碱必然过量,答案为:保证酸完全反应 ;(3)由于醋酸是弱酸,弱酸电离吸热,所以用醋酸代替盐酸,放出的热量偏小,中和反应为放热反应△H<0,测得的△H会偏大,答案为:偏小 偏大;(4)试验中大烧杯未与小烧杯相平,否则散失的热量大,测量误差大,答案为:大烧杯与小烧杯未相平 散热量大;(5)中和热△H =" -" 57.3 kJ·mol–1,50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液反应生成0.025mol水,放出热量0.025mol×57.3 kJ·mol,混合溶液的质量为100mL×1g/mL=100g,根据Q=cm△T,算出△T=3.4℃,答案为:3.4℃.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
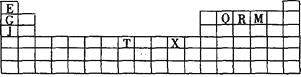

(1)写出基态T3+的核外电子排布式: ;T在周期表中所在分区为 。
(2)Q、R、M的第一电离能由大到小的顺序是 (用元素符号表示),原因 。
(3)下列有关上述元素的说法正确的是 。
A.J比X活泼,所以J可以在溶液中置换出X |
B.将J2M2溶于水,要破坏离子键和共价键 |
C.RE3沸点高于QE4,主要是因为前者相对分子质量较大 |
D.一个Q2E4分子中含有五个δ键和一个π键 |
(4)G2O的熔点比J2O的 (填“高”或“低”) ,其原因是 。
(5) G与R单质直接化合生成一种离子化合物G3R。该晶体具有类似石墨的层状结构。每层中,G原子构成平面六边形,每个六边形的中心有一个R原子。层与层之间还夹杂一定数量的原子。请问这些夹杂的原子应该是 (填G或R的元素符号)。
【题目】下表给出五种短周期元素的相关信息。
元素 | 相关信息 |
A | 常温、常压下,其单质是最轻的气体,它将成为备受青睐的清洁燃料 |
B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
C | 植物生长三要素之一,它能形成多种氧化物,某些氧化物会造成光化学污染 |
D | 室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
E | 常温下其单质为黄绿色气体,其单质水溶液有漂白、杀菌作用 |
请按要求回答下列问题:
(1)D元素核外电子排布 ;
(2)A、B两元素形成的含有非极性键的化合物的结构式 ;A、B两元素形成的具有相同电子数的离子有(填化学式):______________、_____________。
(3)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
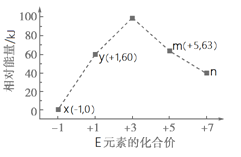
(4)一定条件下,在水溶液中1 mol E-、EO(x=1,2,3,4)的能量(kJ)相对大小如右图所示。n是 (填离子符号)。离子反应y→x+m的热化学方程式为 。
(5)Na2DB3水溶液中各离子浓度的大小顺序是 (填离子符号)