题目内容
17.体积为1L的某溶液中可能含有Cl-、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$、NH${\;}_{4}^{+}$、Fe3+、Al2+、Ba2+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生的白色沉淀迅速变为灰绿色;过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.下列叙述正确的是( )| A. | 溶液中的主要离子仅为SO${\;}_{3}^{2-}$、Fe2+、NH${\;}_{4}^{+}$ | |
| B. | Cl-一定存在,且c(Cl-)=0.2 mol.L-l | |
| C. | 向原溶液中加入硫酸,可能有气体生成 | |
| D. | CO${\;}_{3}^{2-}$、Al2+一定不存在,K+可能存在 |
分析 加入过量NaOH溶液,加热,得到0.02mol气体,可知一定存在铵根离子;产生的白色沉淀迅速变为灰绿色,1.6g固体为三氧化二铁,可知一定有Fe3+,一定没有CO32-;
4.66g不溶于盐酸的沉淀,为硫酸钡沉淀,物质的量为:0.02mol;根据以上数据推算存在离子,根据电荷守恒推算氯离子的存在及数据.
解答 解:加入NaOH溶液共热有气体和白色沉淀,气体为氨气,白色色沉淀转化为灰绿色,最后转化为为氢氧化铁,则溶液中一定含有NH4+、Fe2+,根据离子共存可知不含CO32-,加BaCl2溶液生成不溶于盐酸的沉淀,知溶液中含SO42-,
n(NH3)=0.02mol,知n(NH4+)=0.02mol,
n(Fe2O3)=1.6g/160g•mol-1=0.01mol,根据元素守恒,知n(Fe2+)=0.02mol,
n(BaSO4)=4.66g/233g•mol-1=0.02mol,知n(SO42-)=0.02mol,
溶液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,
据电荷守恒,知溶液中必然大量存在另一种阴离子,所以Cl-、硝酸根离子至少存在一种,故原溶液中一定含Fe2+、NH4+、SO42-和Cl-、硝酸根离子中的至少一种,钾离子、铝离子无法判断.
A、原溶液中一定含Fe2+、NH4+、SO42-和Cl-、硝酸根离子中的至少一种,故A错误;
B、液中NH4+、Fe3+所带正电荷为0.02mol+3×0.02mol=0.08mol,SO42-所带负电荷为2×0.02mol=0.04mol,据电荷守恒,知溶液中必然大量存在另一种阴离子,Cl-、硝酸根离子中的至少一种,故B错误;
C、向原溶液中加入硫酸,可能存在硝酸根离子,硝酸能将亚铁离子氧化,产生一氧化氮气体,可能有气体生成,故C正确;
D、溶液中肯能存在铝离子,故D错误.
故选C.
点评 本题考查离子共存,为高考常见题型和高频考点,侧重于元素化合物知识的综合理解和运用的考查,注意常见离子的性质和反应类型的判断,答题时认真阅读、分析题中数据,合理分析,特别是氯离子的推断,难度中等.

| A. | 增大反应物的浓度,可增大活化分子的百分数,从而使反应速率增大 | |
| B. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| C. | NH4HCO3 (s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | 升温能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数 |
| A. | 将40g NaOH溶解于1L 水中 | |
| B. | 将22.4L氨气溶于水配成1L溶液 | |
| C. | 将1 L10mol•L-1的浓盐酸与9L水混合 | |
| D. | 将4g NaOH溶解在水中配成100mL溶液 |
| A. |  制取并收集干燥的NH3 | B. | 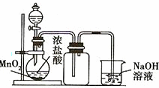 制取并收集Cl2 | ||
| C. | 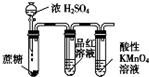 检验浓硫酸与蔗糖反应产生的SO2 | D. | 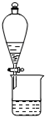 可分离I2和CCl4的混合物 |
 进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”.目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物.
进入秋冬季节后,郑州市频现雾霾天气,给人们的出行带来极大的不便和危害,人们“谈霾色变”.目前郑州市汽车保有量达230万量,汽车尾气的污染是引起雾霾的主要因素之一,NO和CO是汽车尾气的主要污染物.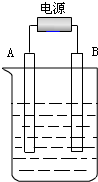 在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题:
在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色稀溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成;当溶液中的原溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量,电极增重1.6g.请回答下列问题: 实验室常用的几种气体发生装置如图甲A、B、C所示:
实验室常用的几种气体发生装置如图甲A、B、C所示: