题目内容
6.用下列有关实验装置进行的相应实验,能达到实验目的是( )| A. |  制取并收集干燥的NH3 | B. | 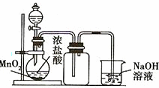 制取并收集Cl2 | ||
| C. | 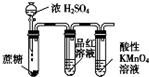 检验浓硫酸与蔗糖反应产生的SO2 | D. | 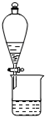 可分离I2和CCl4的混合物 |
分析 A.氨气的密度比空气的密度小;
B.浓盐酸与二氧化锰反应制备氯气,需要加热;
C.浓硫酸具有脱水性、强氧化性,C与浓硫酸反应生成二氧化硫;
D.I2和CCl4的混合物互溶,但沸点不同.
解答 解:A.氨气的密度比空气的密度小,应利用向下排空气法收集,图中收集方法不合理,故A错误;
B.浓盐酸与二氧化锰反应制备氯气,需要加热,图中缺少酒精灯加热,故B错误;
C.浓硫酸具有脱水性、强氧化性,C与浓硫酸反应生成二氧化硫,则图中品红褪色,高锰酸钾褪色可说明浓硫酸与蔗糖反应产生的SO2,故C正确;
D.I2和CCl4的混合物互溶,但沸点不同,不能利用分液法,应选蒸馏法,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的制备实验及混合物分离提纯等,把握物质的性质、反应原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
16.莽草酸结构简式如图.下列说法错误的是( )
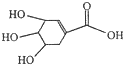

| A. | 该物质分子式为C7H10O5 | |
| B. | 该物质与乙酸互为同系物 | |
| C. | 该物质能与乙醇发生酯化反应 | |
| D. | 1mol该物质与Na反应时,最多消耗Na 4mol |
17.体积为1L的某溶液中可能含有Cl-、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$、NH${\;}_{4}^{+}$、Fe3+、Al2+、Ba2+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生的白色沉淀迅速变为灰绿色;过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.下列叙述正确的是( )
| A. | 溶液中的主要离子仅为SO${\;}_{3}^{2-}$、Fe2+、NH${\;}_{4}^{+}$ | |
| B. | Cl-一定存在,且c(Cl-)=0.2 mol.L-l | |
| C. | 向原溶液中加入硫酸,可能有气体生成 | |
| D. | CO${\;}_{3}^{2-}$、Al2+一定不存在,K+可能存在 |
14.实验室中经常因为试剂的保存方法不当导致大量药品变质,下列试剂保存方法正确的是( )
| A. | 金属钠保存在水中 | |
| B. | 溴水放在带橡胶塞的试剂瓶中 | |
| C. | 硝酸银保存在棕色广口瓶中,并置于阴凉处 | |
| D. | 氢氧化钾溶液保存在磨口玻璃塞的试剂瓶中 |
1.你认为下列说法不合理的是( )
| A. | 塑料制品长期不使用也会老化 | |
| B. | 可以通过与盐酸的互滴实验鉴别碳酸钠和碳酸氢钠 | |
| C. | 过氧化钠可以作供氧剂,可以和二氧化硫反应生成亚硫酸钠和氧气 | |
| D. | 纯碱是 Na2C03,小苏打是 NaHC03,其水溶液均呈碱性 |
11.在标准状况下,mg气体A与ng气体B的分子数相同,下列说法中正确的是( )
| A. | 同温同压下,两气体A与B的密度之比为n:m | |
| B. | 同质量的A、B两种气体的分子数之比为m:n | |
| C. | 相同状况下,同体积的气体A和B的质量比为n:m | |
| D. | A与B两种气体的相对分子质量之比为m:n |
18.下列反应中,水做氧化剂的是( )
| A. | SO3+H2O═H2SO4 | B. | 2Na+2H2O═2NaOH+H2↑ | ||
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O | D. | 2F2+2H2O═4HF+O2 |
16.在一个固定体积的密闭容器中,加入4mol A和2mol B发生反应:2A(g)+B(g)?3C(g)+D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达到平衡后,C的浓度仍为Wmol/L的是( )
| A. | 8mol A+4mol B | B. | 2mol A+1mol B | ||
| C. | 6mol C+2mol D+2mol B | D. | 6mol C+2mol D |
