题目内容
5.下列说法错误的是( )| A. | 增大反应物的浓度,可增大活化分子的百分数,从而使反应速率增大 | |
| B. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| C. | NH4HCO3 (s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | 升温能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数 |
分析 A、增大反应物浓度,可增大反应体系中单位体积活化分子的数目,活化分子百分数不变;
B、决定化学反应速率的主要因素是内因:物质本身的性质;
C、该反应为吸热反应,不能自发进行,而最终该反应能自发进行,则一定是熵增反应占主要作用;
D、升高温度,提供能量,使活化分子的百分数增大.
解答 解:A、增大反应物浓度,可增大反应体系中单位体积活化分子的数目,活化分子百分数不变,故A错误;
B、决定化学反应速率的主要因素是内因:参加反应的物质的性质,故B正确;
C、该反应为吸热反应,不能自发进行;而最终该反应能自发进行,则主要原因是体系有自发地向混乱度增加的方向转变的倾向,故C正确;
D、升高温度,提供能量,使活化分子的百分数增大,因而反应速率增大,故D正确;
故选A.
点评 本题考查学生化学反应速率的影响因素、化学反应的方向方面的知识,注意知识的归纳和梳理是关键,难度中等.

练习册系列答案
相关题目
15. 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.
I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表.
则该温度下反应的平衡常数K=1.2.(保留2位有效数字)
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,此时v (正)< v (逆)(填“>”“=”或“<”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1'.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
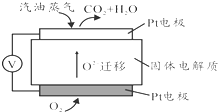
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(6)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(7)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照、叶绿素}{→}$ C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是a,反应b中理论上原子利用率为46%.
 通过煤的气化和液化,使碳及其化合物得以广泛应用.
通过煤的气化和液化,使碳及其化合物得以广泛应用.I.工业上先用煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:CO(g)+H2O(g)?CO2(g)+H2(g)
(1)向1L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表.
| t/min | 0 | 1 | 2 | 3 | 4 |
| n(H2O)/mol | 0.600 | 0.520 | 0.450 | 0.350 | 0.350 |
| n(CO)/mol | 0.400 | 0.320 | 0.250 | 0.150 | 0.150 |
(2)相同条件下,向2L恒容密闭容器中充入1molCO、1mol H2O(g)、2molCO2、2mo1H2,此时v (正)< v (逆)(填“>”“=”或“<”).
Ⅱ.已知CO(g)、H2(g)、CH3OH(l)的燃烧热分别为283kJ•mol-1、286kJ•mol-1、726kJ•mol-1'.
(3)利用CO、H2合成液态甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(l)△H=-129kJ•mol-1.
(4)依据化学反应原理,分析增加压强对制备甲醇反应的影响增加压强使反应速率加快,同时平衡右移,CH3OH产率增大.
Ⅲ.为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如右图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
(5)以辛烷(C8H18)代表汽油,写出该电池工作时的负极反应方程式C8H18-50e-+25O2-=8CO2+9H2O.
(6)已知一个电子的电量是1.602×10-19C,用该电池电解饱和食盐水,当电路中通过1.929×105C的电量时,生成NaOH80g.
Ⅳ.煤燃烧产生的CO2是造成温室效应的主要气体之一.
(7)将CO2转化成有机物可有效地实现碳循环.如:
a.6CO2+6H2O$\stackrel{光照、叶绿素}{→}$ C6H12O6+6O2
b.2CO2+6H2$→_{△}^{催化剂}$C2H5OH+3H2O
c.CO2+CH4$→_{△}^{催化剂}$CH3COOH
d.2CO2+6H2$→_{△}^{催化剂}$CH2=CH2+4H2O
以上反应中,最节能的是a,反应b中理论上原子利用率为46%.
16.莽草酸结构简式如图.下列说法错误的是( )
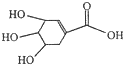

| A. | 该物质分子式为C7H10O5 | |
| B. | 该物质与乙酸互为同系物 | |
| C. | 该物质能与乙醇发生酯化反应 | |
| D. | 1mol该物质与Na反应时,最多消耗Na 4mol |
10.把镁带投入盛有盐酸的敞口容器里,在下列因素中:①盐酸的浓度,②镁带的表面积,③溶液的温度,④氯离子的浓度 ⑤滴加硫酸铜溶液.对反应速率有影响的是( )
| A. | ①② | B. | ③④ | C. | ①②③④ | D. | ①②③⑤ |
17.体积为1L的某溶液中可能含有Cl-、NO${\;}_{3}^{-}$、SO${\;}_{4}^{2-}$、CO${\;}_{3}^{2-}$、NH${\;}_{4}^{+}$、Fe3+、Al2+、Ba2+和K+.取该溶液100mL,加入过量NaOH溶液,加热,得到0.02mol气体,同时产生的白色沉淀迅速变为灰绿色;过滤、洗涤、灼烧,得到1.6g固体;向上述滤液中加入足量BaCl2溶液,得到4.66g不溶于盐酸的沉淀.下列叙述正确的是( )
| A. | 溶液中的主要离子仅为SO${\;}_{3}^{2-}$、Fe2+、NH${\;}_{4}^{+}$ | |
| B. | Cl-一定存在,且c(Cl-)=0.2 mol.L-l | |
| C. | 向原溶液中加入硫酸,可能有气体生成 | |
| D. | CO${\;}_{3}^{2-}$、Al2+一定不存在,K+可能存在 |
14.实验室中经常因为试剂的保存方法不当导致大量药品变质,下列试剂保存方法正确的是( )
| A. | 金属钠保存在水中 | |
| B. | 溴水放在带橡胶塞的试剂瓶中 | |
| C. | 硝酸银保存在棕色广口瓶中,并置于阴凉处 | |
| D. | 氢氧化钾溶液保存在磨口玻璃塞的试剂瓶中 |
