题目内容
(1)有甲、乙、丙、丁四种金属,把甲、丙浸入稀硫酸中,用导线连接时丙为负极;把乙、丁分别浸入稀硫酸中,丁产生气泡的速率更大;把甲、乙用导线连接浸入稀硫酸中,甲上有气泡冒出;把丙浸入丁的硝酸盐溶液中,丙的表面有丁析出。这四种金属的活动性由强到弱的顺序是 。
(2)向5mLNaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度大小关系为_______________。
(3) 现将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是_______________
①20 mL 0.01 mol·L-1KCl溶液
②30 mL 0.02 mol·L-1CaCl2溶液
③40 mL 0.03 mol·L-1HCl溶液
④10 mL蒸馏水
⑤50 mL 0.05 mol·L-1 AgNO3溶液
(4)某种甲醇燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接加入纯化后的甲醇,同时向一个电极通入空气。此电池的负极发生的电极反应式是_______________ ;
(5)某酸H2B在水溶液中有如下变化:H2B H++HB-;HB-
H++HB-;HB- H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
H++B2-;现有溶液 0.10mol/L、100ml,试回答以下问题:
①溶液中的H+物质的量取值范围是:
②已知0.1mol·L-1NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度可能是 0.11 mol·L-1(填“<”,“>”,或“=”)
(1) 丙丁乙甲
(2)AgCl>AgI>Ag2S
(3)④>①>③>②>⑤
(4)
(5)(1)0.01<n(H+)<0.02 (2) <
解析试题分析:(1)金属性强弱体现在与酸反应时的剧烈程度,组合成原电池时两极的现象,及金属间的置换反应;(2)向某难溶物的溶液中滴加其他溶液时可生成溶解度更小的物质;(3)由同离子效应可确定AgCl在不同溶液中的溶解度大小顺序为④>①>③>②>⑤;(4)甲醇燃料电池的负极物为甲醇,反应式为2CH3OH+2H2O-12e-=2CO2+12H+;(5)H2B在水溶液中电离方程式可知,H2B为强酸,HB-为弱酸,所以溶液H+的物质的量范围为0.01<n(H+)<0.02 ;0.1mol·L-1NaHB溶液的pH=2,则0.1mol/L的HB-电离的H+为0.01mol/L,而0.1mol/L的H2B中,第一步电离出的0.1mol/L的H+会抑制第二步电离,导致氢离子浓度小于0.11mol/L。
考点:金属活动性的比较、难溶电解质间的转化、原电池原理、多元酸的电离。

下表是不同温度下水的离子积的数据:
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则a________1×10-14(填“>”、“<”或“=”),做此判断的理由是___________________________________________________。
(2)25 ℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=________。
(3)在t2温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a∶b=________。
蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 3.3 | 9.4 |
| 完全沉淀的pH | 3.7 | 5.2 | 11.0 |
实验步骤如下:
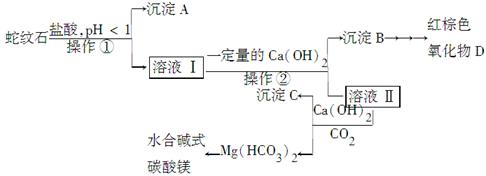
(1)实验室完成操作①所用到的玻璃仪器有:________。
(2)操作②中应控制溶液pH的合理范围是________(填序号)。
A.小于1.5 B.1.5~3.3 C.7~8 D.大小9.4
(3)检验溶液Ⅱ中是否含有Fe3+的操作与结论是______________________。
(4)从沉淀混合物B中制取D,应加入一种试剂进行分离,其反应的离子方程式为________,再进行________、洗涤、________(依次填写实验操作名称)。
请回答有关滴定过程中的相关问题。
(1)用已知浓度的氢氧化钠溶液滴定未知浓度的盐酸,滴定曲线如图所示。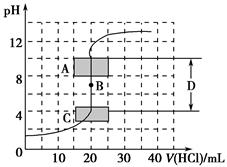
①在图中A的pH范围使用的指示剂是________;
C的pH范围使用的指示剂是________。
②下列关于上述中和滴定过程中的操作,正确的是________(填序号)。
| A.用碱式滴定管量取已知浓度的烧碱溶液 |
| B.滴定管和锥形瓶都必须用待装液润洗 |
| C.滴定过程中始终注视锥形瓶中溶液颜色变化 |
| D.锥形瓶中的待测液可用量筒量取 |
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
请回答:
①从a组情况分析, HA是强酸还是弱酸 。
②b组情况表明,c 0.2 (选填“大于”、“小于”或 “等于”)。混合溶液中离子浓度c(A-)_______ c(Na+)。(选填“大于”、“小于”或 “等于”)
③ a组实验所得混合溶液中由水电离出的c(OH-)= mol·L-1。
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| NH3·H2O | Kb=1.77×10-5 |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7,Ka2=5.61×10-11 |
(1)25℃时,pH=11的NaCN溶液中水电离出的c(OH-)____________mol/L。
(2)25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三种溶液的pH由大到小的顺序为________。
(3)NH4Cl溶液呈______性(填“酸”、“碱”或“中”,下同),NH4HCO3溶液呈_______性,0.1mol/LNH4HCO3溶液中物质的量浓度最大的离子是_________(填化学式)。
(4)25℃时,等浓度的CH3COOH溶液和CH3COONa溶液等体积混合,混合溶液中各种离子浓度大小_________。
(5)向NaCN溶液中通入少量CO2,所发生反应的化学方程式______________。