题目内容
【题目】二氧化氯(ClO2)是一种黄绿色气体,易溶于水,在混合气体中的体积分数大于10%就可能发生爆炸,在工业上常用作水处理剂、漂白剂。回答下列问题:
(1)在处理废水时,ClO2可将废水中的CN-氧化成CO2和N2,写出该反应的离子方程式:____。
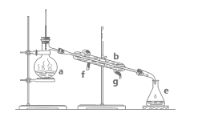
(2)某小组设计了如图所示的实验装置用于制备ClO2。
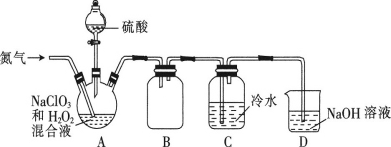
①通入氮气的主要作用有2个,一是可以起到搅拌作用,二是____。
②装置B的作用是____。
③装置A用于生成ClO2气体,该反应的离子方程式为____。
④当看到装置C中导管液面上升时应进行的操作是___。
(3)测定装置C中ClO2溶液的浓度:取10mLC中溶液于锥形瓶中,加入足量的KI溶液和H2SO4酸化,然后加入___作指示剂,用0.1000mol·L-1的Na2S2O3标准液滴定锥形瓶中的溶液(2ClO2+10I-+8H+=5I2+2Cl-+4H2O,I2+2S2O32-=2I-+S4O62-),测得标准液消耗的体积为20.00mL,通过计算可知C中ClO2溶液的浓度为___mol·L-1。
【答案】2ClO2+2CN-=2CO2+N2+2Cl- 稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸 防止倒吸(或作安全瓶) 2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O 加大氮气的通入量 淀粉溶液 0.04
【解析】
(1)ClO2可将废水中的CN氧化成CO2和N2,离子方程式为:2ClO2+2CN=2CO2+N2+2Cl;故答案为:2ClO2+2CN=2CO2+N2+2Cl;
(2)①由于二氧化氯(ClO2)在混合气体中的体积分数大于10%就可能发生爆炸,氮气可以起到搅拌作用,还能稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;故答案为:稀释二氧化氯,防止因二氧化氯的浓度过高而发生爆炸;
②ClO2气体易溶于水,故B的作用是防止倒吸(或作安全瓶);故答案为:防止倒吸(或作安全瓶);
③装置A为NaClO3和H2O2在酸性条件下生成ClO2气体,化学反应为:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O,所以离子方程式为2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O;故答案为:2ClO3-+H2O2+2H+=2ClO2↑+O2↑+2H2O;
④装置C中导管液面上升说明ClO2浓度过大,为防止发生爆炸,应加大氮气的通入量;故答案为:加大氮气的通入量;
(3)ClO2溶液加入足量的KI溶液和H2SO4酸化氧化I为I2,用淀粉做指示剂,溶液蓝色褪去且半分钟内不恢复原色达到滴定终点;根据关系式:2ClO25I210Na2S2O3,则n(ClO2)=![]() =
=![]() ,C中ClO2溶液的浓度为
,C中ClO2溶液的浓度为![]() ;故答案为:淀粉溶液;0.04。
;故答案为:淀粉溶液;0.04。

 考前必练系列答案
考前必练系列答案