题目内容
6.电化学原理在化学工业的应用非常广泛.要用电解方法精炼粗铜,电解液选用CuSO4溶液,则
①阳极的材料是粗铜,电极反应式是Cu-2e-=Cu2+.
②阴极的材料是纯铜,电极反应式是Cu2++2e-=Cu.
(说明:杂质发生的电极反应不必写出)
分析 电解法精炼铜时,粗铜为阳极,精铜为阴极,电解质溶液为硫酸铜,阳极材料是粗铜,阳极上失电子变成离子进入溶液,Cu-2e-=Cu2+,比金属铜活泼的金属锌、铁、镍会先于金属铜失电子,阴极上是铜离子得电子的还原反应,根据电解原理来回答.
解答 解:①电解法精炼铜时,粗铜为阳极,精铜为阴极,电解质溶液为硫酸铜,阳极材料是粗铜,阳极上失电子变成离子进入溶液,电极反应式:Cu-2e-=Cu2+,
故答案为:粗铜;Cu-2e-=Cu2+;
②精铜为阴极,阴极上是铜离子得电子的还原反应,即Cu2++2e-=Cu,故答案为:纯铜;Cu2++2e-=Cu.
点评 本题考查学生电解精炼铜的工作原理,把握阳极、阴极材料及电极反应为解答的关键,难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
17.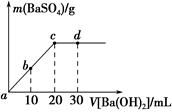 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
 常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )
常温下,向0.25mol•L-1的硫酸氢钠溶液中逐滴加入物质的量浓度相同的氢氧化钡溶液,生成沉淀的量与加入氢氧化钡溶液的体积关系如图所示,a、b、c、d分别表示实验不同时刻的溶液,下列有关说法中正确的是( )| A. | 硫酸氢钠溶液的体积为10 mL | |
| B. | 溶液的导电能力:c<b<a | |
| C. | d时刻溶液的pH为13 | |
| D. | b时刻溶液中SO42-的浓度约为0.125 mol•L-1 |
11.如图所示微观变化的化学反应类型,与下列反应的反应类型一致的是( )
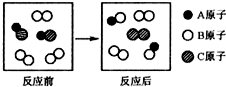

| A. | 2KClO3 $\frac{\underline{MnO_2}}{△}$2KCl+3O2 | B. | 2HI+Cl2═2HCl+I2 | ||
| C. | CO2+C $\frac{\underline{\;高温\;}}{\;}$2CO | D. | 2HCl+CuO═CuCl2+H2O |
18.在0.01mol/L HCl溶液中,C(OH-)=10-12mol/L,C(H+)=0.01mol/L,由水电离出的H+浓度为10-12mol/L,由水电离出的OH-浓度为10-12mol/L.
15.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 10 mol•L-1 Na2SO4溶液中,粒子总数是0.83NA | |
| B. | 1 mol Fe3+完全水解,生成红氧化铁胶体位子的数目为NA | |
| C. | 常温常压下,16g O2和O3的混合气体中所含电子的数目为8NA | |
| D. | 标准状况下,分子数为NA的N2、C2H4混合气体的质量无法确定 |
16.已知NaN3与硝酸钾可以发生反应:10NaN3+2KNO3═K2O+5Na2O+16N2↑,NA表示阿伏加德罗常数的值.若还原产物所含的氮原子比氧化产物所含的氮原子少2.8mol,则下列判断正确的是( )
| A. | 有1.25mol NaN3被氧化 | B. | 被还原的N原子的数目是0.2NA | ||
| C. | 转移电子的物质的量为2mol | D. | 标准状况下生成44.8L N2 |

