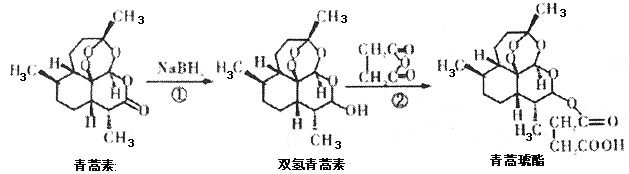
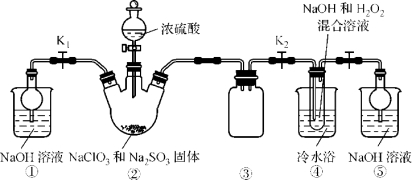
题目内容
【题目】下表是元素周期表的一部分,请参照元素
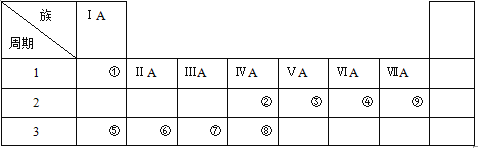
(1)①~⑨中金属性最强的元素是(填元素符号) ,非金属性最强的元素是(填元素符号) 。
(2)④、⑤、⑦的原子半径由大到小的顺序为(填元素符号) 。
(3)②、③的最高价氧化物的水化物的酸性强弱顺序为(填化学式) 。
(4)由①、④元素按原子个数比2:1组成的化合物的电子式为 。
(5)由②和④组成的化合物与⑥单质反应的化学方程式为 。
(6)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为 。
【答案】(1)Na F
(2)Na>Al>O
(3)HNO3>H2CO3
(4)![]()
(5)2Mg+CO2![]() 2MgO+C
2MgO+C
(6)2Al+2OH-+2H2O=2AlO2-+3H2↑
【解析】试题分析:根据元素在周期表中的位置可知①~⑨分别是H、C、N、O、Na、Mg、Al、Si、F。则
(1)①~⑨中金属性最强的元素是Na,非金属性最强的元素是F。
(2)同周期自左向右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,则④、⑤、⑦的原子半径由大到小的顺序为Na>Al>O。
(3)非金属性越强,最高价含氧酸的酸性越强,氮元素的非金属性强于碳元素,则最高价氧化物的水化物的酸性强弱顺序为HNO3>H2CO3。
(4)由①、④元素按原子个数比2:1组成的化合物是水,含有共价键,电子式为![]() 。
。
(5)由②和④组成的化合物二氧化碳与⑥单质反应的化学方程式为2Mg+CO2![]() 2MgO+C。
2MgO+C。
(6)⑦单质与⑤的最高价氧化物的水化物反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑。

 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
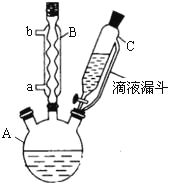
能考试全能100分系列答案【题目】(14 分)对氯苯甲酸是合成非甾族消炎镇痛药的中间体,还能用于燃料和农药的合成,实验室中制备对氯苯甲酸的反应、装置图如下:
![]()
![]()
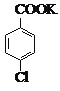 +MnO2
+MnO2 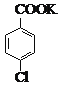
![]()
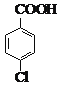
常温条件下的有关数据如下表所示:
相对分子质量 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 颜色 | 水溶性 | |
对氯甲苯 | 126.5 | 7.5 | 162 | 1.07 | 无色 | 难溶 |
对氯苯甲酸 | 156.5 | 243 | 275 | 1.54 | 白色 | 微溶 |
对氯苯甲酸钾 | 194.5 | 具有盐的通性,属于可溶性盐 | ||||
实验步骤:在规格为250mL的装置A中加入一定量的催化剂、适量KMnO4、100mL水;安装好装置,在滴液漏斗中加入6.00mL对氯甲苯,在温度为93℃左右时,逐滴滴入对氯甲苯;控制温度在93℃左右,反应2h,过滤,将滤渣用热水洗涤,使洗涤液与滤液合并,加入稀硫酸酸化,加热浓缩;然后过滤,将滤渣用冷水进行洗涤,干燥后称量其质量为7.19g。
请回答下列问题:
(1)装置B的名称是 。
(2)量取6.00mL对氯甲苯应选用的仪器是 。(填选仪器序号)
A.10mL量筒 B.50mL容量瓶 C.50mL酸式滴定管 D.50mL碱式滴定管
(3)控制温度为93℃左右的方法是 。对氯甲苯的加入方法是逐滴加入而不是一次性加入,原因是 。
(4)第一次过滤的目的是 ,滤液中加入稀硫酸酸化,可观察到的实验现象是 。
(5)第二次过滤所得滤渣要用冷水进行洗涤,其原因是 。
(6)本实验的产率是 (填标号)。A.60% B.70% C.80% D.90%