题目内容
(14分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程下如下:
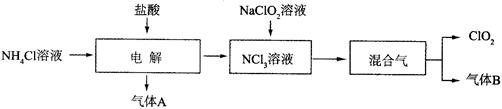
已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)实验室制取气体B的化学方程式为 。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将锥形瓶“在暗处静置30 min”,立即进行步骤3,则测定的结果可能
(选填“偏大”、“偏小”、“无影响”);
②上述步骤3中滴定终点的现象是 。
③根据上述步骤可计算出原ClO2溶液的浓度为 g / L(用含字母的代数式表示)。

已知:①NCl3是黄色黏稠状液体或斜方形晶体,极易爆炸,有类似氯气的刺激性气味,自然爆炸点为95℃,在热水中易分解,在空气中易挥发,不稳定。②气体B能使湿润的红色石蕊试纸变蓝。
回答下列问题:
(1)电解时,发生反应的化学方程式为 。为保证实验的安全,在电解时需注意的问题是:①控制好生成NCl3的浓度;② 。
(2)NCl3与NaClO2(亚氯酸钠)按物质的量之比为1∶6混合,在溶液中恰好反应生成ClO2,该反应的离子方程式为 。
(3)实验室制取气体B的化学方程式为 。
(4)ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10 mL,稀释成100 mL试样;
步骤2:量取V1 mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30 min。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。
(已知I2+2S2O32-=2I-+S4O62-)
①若步骤2中未将锥形瓶“在暗处静置30 min”,立即进行步骤3,则测定的结果可能
(选填“偏大”、“偏小”、“无影响”);
②上述步骤3中滴定终点的现象是 。
③根据上述步骤可计算出原ClO2溶液的浓度为 g / L(用含字母的代数式表示)。
(1)NH4Cl + 2HCl 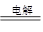 3H2↑+ NCl3 (2分) 控制好反应的温度(2分)
3H2↑+ NCl3 (2分) 控制好反应的温度(2分)
(2)NCl3 + 6ClO2— + 3H2O = 6ClO2↑+ NH3↑+ 3Cl— + 3OH—(2分)
(3)2NH4Cl + Ca(OH)2 CaCl2 + 2NH3↑+ 2H2O(2分)
CaCl2 + 2NH3↑+ 2H2O(2分)
(若写NH3·H2O + CaO = NH3↑+ Ca(OH)2也给分)
(4)①偏小 (2分)
②最后一滴滴入后溶液由蓝色变为无色,且30 s不变色 (2分)
③135cV2/ V1(2分)
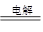 3H2↑+ NCl3 (2分) 控制好反应的温度(2分)
3H2↑+ NCl3 (2分) 控制好反应的温度(2分)(2)NCl3 + 6ClO2— + 3H2O = 6ClO2↑+ NH3↑+ 3Cl— + 3OH—(2分)
(3)2NH4Cl + Ca(OH)2
 CaCl2 + 2NH3↑+ 2H2O(2分)
CaCl2 + 2NH3↑+ 2H2O(2分)(若写NH3·H2O + CaO = NH3↑+ Ca(OH)2也给分)
(4)①偏小 (2分)
②最后一滴滴入后溶液由蓝色变为无色,且30 s不变色 (2分)
③135cV2/ V1(2分)
试题分析:(1)本小题考查的电解反应即是一个氧化还原反应,可根据反应物和产物来推断出A气体是氢气,然后即可写出电解方程式,NCl3的自然爆炸点为95℃,在热水中易分解,故需要控制好反应温度。(2)按反应物比例书写方程式,改写为离子式即可,即NCl3 + 6ClO2— + 3H2O = 6ClO2↑+ NH3↑+ 3Cl— + 3OH—。(3)由题意知,气体B为NH3。(4)在暗处静置是为了使ClO2与KI充分反应,若不静置,ClO2反应不完全,测得的结果就偏小。淀粉遇碘变蓝色,Na2S2O3溶液会消耗碘单质,故滴定终点现象为最后一滴滴入后溶液由蓝色变为无色,且30 s不变色。ClO2溶液与碘化钾反应的离子方程式8H+ + 2ClO2 + 10I-=4H2O + 5I2 + 2Cl-,I2+2S2O32-=2I-+S4O62-。即有ClO2~5S2O32-,原ClO2溶液的浓度为(cV2/5V1)×10×67.5=135cV2/ V1。
点评:本题简单考查了学生的推断能力,重点在于学生对方程式的掌握和书写,第四小题较难,还涉及到了化学计算,但是关键在于ClO2溶液与碘化钾的反应,只要学生写对了反应式,接下来的计算就很简单了。综合考虑,该题难度较大。

练习册系列答案
相关题目

 Na2CO3 + H2O +CO2↑
Na2CO3 + H2O +CO2↑