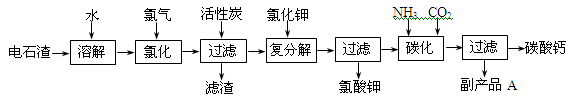
题目内容
实验室要用4 mol·L-1的浓硫酸配制500 mL 0.2 mol·L-1的稀H2SO4溶液。
(1).实验中所需用到的主要玻璃仪器有:量筒、烧杯、玻璃棒、 、 等。
(2).需用浓度为4mol/L的浓硫酸的体积为多少mL?
(3).取20 mL该稀溶液,然后加入足量的锌粒,求生成的气体体积(标况下)。
(1).实验中所需用到的主要玻璃仪器有:量筒、烧杯、玻璃棒、 、 等。
(2).需用浓度为4mol/L的浓硫酸的体积为多少mL?
(3).取20 mL该稀溶液,然后加入足量的锌粒,求生成的气体体积(标况下)。
(1)500ml 容量瓶 滴管 (2)0.025L (3)0.896L
试题分析:(1)用浓硫酸配制500ml稀硫酸,则需要的仪器除量筒、烧杯、玻璃棒外还需要500ml容量瓶和定容时的胶头滴管。
(2)根据C1V1 = C2V2
则0.5×0.2 =4×V2
解得 V2=0.025(L)
(3) Zn + H2SO4 = ZnSO4 + H2 ↑
1 mol 22.4L
0.02L×0.2mol/L VL
解得 V=0.896L
点评:该题是基础性试题的考查,试题注重基础,难易适中,有助于培养学生的规范答题能力,提高学生的逻辑思维能力和灵活应变能力。该题难度不大,学生不难得分。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案
相关题目