题目内容
【题目】![]() 、
、![]() 、
、![]() 、
、![]() 为短周期元素,其原子半径、化合价等信息见下表。以下说法一定正确的是( )
为短周期元素,其原子半径、化合价等信息见下表。以下说法一定正确的是( )
元素 |
|
|
|
|
原子半径( | 0.077 | 0.070 | 0.104 | 0.099 |
最高正价或最低负价 | +4 | +5 | -2 | -1 |
A.![]() 与
与![]() 形成的化合物的电子式可表示为
形成的化合物的电子式可表示为![]()
B.![]() 的氢化物能与
的氢化物能与![]() 的氢化物反应,所得产物只含有共价键
的氢化物反应,所得产物只含有共价键
C.![]() 、
、![]() 能分别与氧元素形成多种氧化物
能分别与氧元素形成多种氧化物
D.![]() 处于元素同期中第三周期ⅣA族
处于元素同期中第三周期ⅣA族
【答案】C
【解析】
X、Y、Z、W为四种短周期元素,X的最高正化合价为+4,处于第ⅣA族,Y的最高正化合价为+5,处于第ⅤA族,Z的最低负化合价为-2,处于ⅥA族,W的最低负化合价为-1,处于ⅦA族,由于同周期,自左而右,原子半径减小,而原子半径Z>W>X>Y,故Z、W处于第三周期,X、Y处于第二周期,故X为碳元素,Y为氮元素,Z为硫元素,W为Cl元素,据此分析解答。
由上述分析可知,X为C元素、Y为N元素、Z为S元素、W为Cl元素。
A.X与W形成的化合物为CCl4,碳原子与氯原子之间形成1对共用电子对,氯原子含有3对孤对电子,电子式为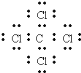 ,故A错误;
,故A错误;
B.Y的氢化物为氨气,W的氢化物为氯化氢,能够反应生成氯化铵,氯化铵属于离子化合物,含有离子键与共价键,故B错误;
C.X的氧化物有CO、CO2,Y的氧化物有NO、NO2等,故C正确;
D.Z为硫元素,处于元素周期表中第3周期ⅥA族,故D错误;
故选C。

【题目】呋喃甲酸俗称糠酸,广泛应用于塑料工业、食品行业、涂料、医药、香料等。用呋喃甲醛制备呋喃甲酸和副产品呋喃甲醇的原理为:
反应1:![]() +NaOH
+NaOH![]()
![]() △H<0
△H<0
反应2:![]() +HCl
+HCl![]()
![]() +HCl
+HCl
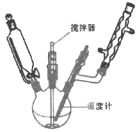
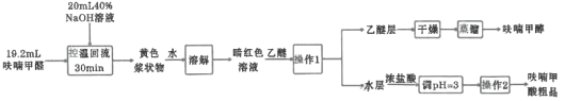
某研究性学习小组利用上图装置制备呋喃甲酸的实验流程如下:
已知:①乙醚(![]() )沸点34.6℃,其蒸气有毒,可使人失去知觉。
)沸点34.6℃,其蒸气有毒,可使人失去知觉。
②主要试剂相关物理性质如下:
试剂 | 相对分子质量 | 密度/ | 熔点/℃ | 沸点/℃ | 溶解性 |
呋喃甲醛 | 96 | 1.16 |
| 161.7 | 微溶于水,易溶于乙醇、乙醚。 |
呋喃甲醇 | 98 | 1.13 |
| 171.0 | 溶于水,可混溶于乙醇、乙醚。 |
呋喃甲酸 | 112 | - | 129.5 | 231.0 | 微溶于冷水,在热水中溶解度较大,易溶于乙醇、乙醚。 |
请回答下列问题:
(1)“控温回流”时需控制反应温度8~12℃,应采取的控温方式是________,三颈烧瓶中所加入的![]() 溶液应如何预处理________,滴加呋喃甲醛时需________。
溶液应如何预处理________,滴加呋喃甲醛时需________。
(2)在“控温回流”时充分搅拌才能获得较高产率。其原因是________。
(3)“操作1”的名称为________,所用到的玻璃仪器主要有________,“操作2”主要包括________、________。
(4)“蒸馏”时,用下图________(填字母标号)装置更好,与另一装置相比,该装置的优点有①________;②________。
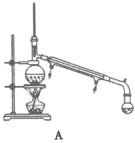
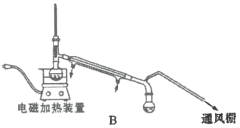
(5)呋喃甲酸粗品精制所采用的方法是________,最终得到精产品9.86g,呋喃甲酸的产率为________。