题目内容
【题目】常见的太阳能电池有单晶硅太阳能电池、多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒等多种元素构成薄膜太阳能电池。回答下列问题:
(1)基态亚铜离子(Cu+)的价层电子排布式为__________。
(2)砷、硒是第四周期的相邻元素,已知砷的第一电离能(947kJ·mo1-1)大于硒(941k]·mol-l)。请从原子结构的角度加以解释__________。
(3)H2O的沸点高于H2Se的沸点,其原因是__________。
(4)GaCl3和AsF3的分子立体构型分别是__________,__________。
(5)硼酸(H3BO3)本身不能电离出H+,在水中易结合一个OH-生成[B(OH)4]-,而体现弱酸性。
①[B(OH)4] -中B原子的杂化类型为__________。
②[B(OH)4] -的结构式为__________。
(6)金刚石的晶胞如图,若以硅原子代替金刚石晶体中的碳原子,便得到晶体硅;若将金刚石晶体中一半的碳原子换成硅原子,且碳、硅原子交替,即得到碳化硅晶体(金刚砂)。

①金刚石、晶体硅、碳化硅的熔点由高到低的排列顺序是__________(用化学式表示)
②金刚石的晶胞参数为apm(lpm=10-12m),1cm3晶体的平均质量为__________g(只要求列算式,阿伏加德罗常数的值为NA)。
【答案】3d10 砷的价电子排布式是4s24p3,4p轨道上的电子处于半充满状态,比较稳定, 气态原子失去一个电子需要的能量比较大 水分子间存在氢键 平面三角形 三角锥形 sp3 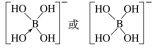 C>SiC>Si 9.6×1031/(a3NA)
C>SiC>Si 9.6×1031/(a3NA)
【解析】
(1)铜是29号元素,其原子核外有29个电子,根据构造原理知,其基态原子核外电子排布式为: 1s22s22p63s23p63d104s1或[Ar]3d104s1。
(2)砷的价电子排布式是4s24p3,4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大,而硒的价电子排布式是4s2 4p4, 4p轨道上失去一个电子才处于半充满状态,故第一电离能较小。
(3)H2O的沸点高于H2Se的沸点,是因为水分子间存在氢键。
(4)GaCl3中Ga原子的价层电子对数为3,没有孤电子对,而AsF3中As原子的价层电子对数为4,有一个孤电子对。
(5)①[B(OH)4]-中B的价层电子对=4+1/2(3+1-4×1)=4,所以采取sp3杂化。
②B原子是缺电子原子,所以该离子中还含有配位键。
(6)①根据键长C-C<C-Si<Si-Si判断。
②金刚石属于面心立方晶胞,根据均摊法计算。
(1)铜是29号元素,其原子核外有29个电子,根据构造原理知,其基态原子核外电子排布式为: 1s22s22p63s23p63d104s1或[Ar]3d104s1,则Cu+在基态时的价电子排布式为3d10, 故答案为:3d10。
(2)砷的价电子排布式是4s24p3,4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大,而硒的价电子排布式是4s2 4p4,4p轨道上失去一个电子才处于半充满状态,故第一电离能较小,故答案为:砷的价电子排布式是4s24p3,4p轨道上的电子处于半充满状态,比较稳定,气态原子失去一个电子需要的能量比较大。
(3)H2O的沸点高于H2Se的沸点,是因为水分子间存在氢键,故答案为:水分子间存在氢键。
(4)GaCl3中Ga原子的价层电子对数为3,没有孤电子对,而AsF3中As原子的价层电子对数为4,有一个孤电子对,故GaCl3空间构型为平面三角形,AsF3的空间构型为三角锥形;
故答案为:平面三角形;三角锥形。
(5)①[B(OH)4]-中B的价层电子对=4+1/2(3+1-4×1)=4,所以采取sp3杂化,故答案为:sp3。
②B原子是缺电子原子,所以该离子中还含有配位键,其结构式为: ,故答案为:
,故答案为: 。
。
(6)①形成的晶体都是原子晶体,由于键长C-C<C-Si<Si-Si,则熔点为金刚石>碳化硅>晶体硅,故答案为:C>SiC>Si。
②金刚石属于面心立方晶胞,即C原子处在立方体的8个顶点,6个面心,体内有4个,根据均摊法推知,一个晶胞中含有8个C原子,又因为一个C原子的质量为12/NAg,一个晶胞中所含C原子的质量为96/NA g,而一个晶胞的体积为(a×10-10)3 cm3,所以1cm3晶体的平均质量为9.6×1031/(a3 NA) g,故答案为:9.6×1031/(a3 NA)。