��Ŀ����
����Ŀ����1����һ��������ܱ������У��������»�ѧ��Ӧ��N2��g��+3H2��g��![]() 2NH3��g����H=-92.4 kJ/mol���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2NH3��g����H=-92.4 kJ/mol���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t/K | 298 | 398 | 498 | ...... |
K/��mol/L��2 | 4.1��106 | K1 | K2 | ...... |
����������⣺
�ٱȽ�K1��K2�Ĵ�С��K1_______K2������>������=������<������
���ں��º�ѹ���жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������_______������ţ���
A 2v��H2��������=3v��NH3�����棩
B 2v��N2��������=v��H2�����棩
C ������ѹǿ���ֲ���
D ���������ܶȱ��ֲ���
��2����ҵ���������صĻ�ѧ����ʽΪ��2NH3��g��+CO2��g��![]() CO��NH2��2��s��+H2O��l������T�棬���Ϊ4L���ܱ������У�ͨ��6molNH3��3molCO2����Ӧ�ﵽƽ��ʱ��c��NH3��=0.5mol��L��1����÷�Ӧ��ƽ�ⳣ��K=_______������ʱ����T���ƽ��ʱ������ѹǿ���䣬��������ɱ�������г���3molNH3�����ʱ��Ӧ��v��_______v��������>����<������=������
CO��NH2��2��s��+H2O��l������T�棬���Ϊ4L���ܱ������У�ͨ��6molNH3��3molCO2����Ӧ�ﵽƽ��ʱ��c��NH3��=0.5mol��L��1����÷�Ӧ��ƽ�ⳣ��K=_______������ʱ����T���ƽ��ʱ������ѹǿ���䣬��������ɱ�������г���3molNH3�����ʱ��Ӧ��v��_______v��������>����<������=������
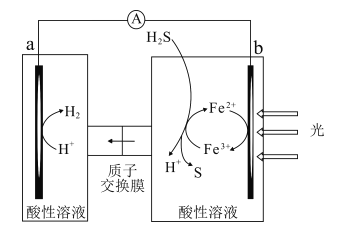
��3����ǿ���Եĵ����ˮ��Һ�У����Բ������缫�����CO2�ɵõ�����ȼ�ϣ���ԭ����ͼ��ʾ��
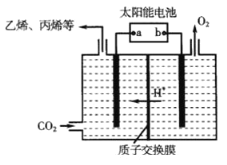
�ٸù���������ת����ʽ��Ҫ��_______��
�ڵ��ʱ��������ϩ�ĵ缫��Ӧʽ��_______��
���𰸡��� AD 16 �� ̫����ת��Ϊ���ܣ�����ת��Ϊ��ѧ�� 2CO2+12e-+12H+=C2H4+4H2O
��������
(1) �ٸ����ʱ��ж������ﷴӦ��Ũ�ȵı仯��Ȼ�����ƽ�ⳣ���жϣ�
�ڿ��淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ�����ֵ�Ũ�ȡ��ٷֺ������ٱ仯���ݴ��жϣ�
(2)����ƽ�ⳣ��K=![]() ���㣻����Ũ����Qc��K�Ĺ�ϵ�жϷ�Ӧ����
���㣻����Ũ����Qc��K�Ĺ�ϵ�жϷ�Ӧ����
(3)��̫���ܵ���ǽ�̫����ת��Ϊ���ܣ����װ���ǽ�����ת��Ϊ��ѧ�ܣ�
��b�������ĵ��ص缫������������������Һ�е�����������ʧȥ���ӱ��������˵���缫Ϊ������
(1) �ٸ÷�Ӧ����Ӧ�Ƿ��ȷ�Ӧ,�����¶�,ƽ�����淴Ӧ�����ƶ�,������Ũ�ȼ�С,��Ӧ��Ũ������,����K1>K2���ʴ�Ϊ��>��
��A.2v(H2)(��)=3v(NH3)(��)��˵�����淴Ӧ������ȣ��÷�Ӧ�ﵽƽ��״̬����A��ȷ��B.2v(N2)(��)=v(H2)(��)����ʾ�������淴Ӧ���ʣ����������������ϵ��˵��û�дﵽƽ��״̬����B����C. ͬ��ͬѹ�����£�ѹǿʼ�ղ��䣬���ܸ���ѹǿ�ж�ƽ��״̬����C����D. ͬ��ͬѹ�£������ݻ�Ϊ�������������������䣬���ܶ�Ϊ�����������������ܶȱ��ֲ���ʱ�������ﵽƽ��״̬����D��ȷ���ʴ�Ϊ��AD��
(2) �¶Ȳ���,ƽ�ⳣ������,ƽ��ʱc(NH3)=0.5mol.L1��c(CO2)=0.25mol.L1��2NH3(g)+CO2(g)CO(NH2)2(s)+H2O(l)��ƽ�ⳣ��K=![]() =16���ʴ�Ϊ16��ͬ��ͬѹ��,����ȵ������ʵ���֮��,����ʱ����T����ƽ��ʱ������ѹǿ����,��������ɱ�������г���3molNH3,�������ΪV L,��
=16���ʴ�Ϊ16��ͬ��ͬѹ��,����ȵ������ʵ���֮��,����ʱ����T����ƽ��ʱ������ѹǿ����,��������ɱ�������г���3molNH3,�������ΪV L,��
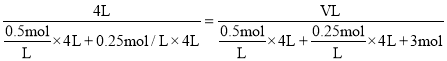 ��ã�V=8L,��ʱQ=
��ã�V=8L,��ʱQ=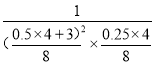 =20.48>16=K��,˵����ʱƽ�����������ƶ�,��V��<V�棬�ʴ�Ϊ<��
=20.48>16=K��,˵����ʱƽ�����������ƶ�,��V��<V�棬�ʴ�Ϊ<��
(3)��̫���ܵ���ǽ�̫����ת��Ϊ���ܣ����װ���ǽ�����ת��Ϊ��ѧ�ܣ��ʴ�Ϊ������ת��Ϊ���ܣ�����ת��Ϊ��ѧ�ܣ�
��b�������ĵ��ص缫������������������Һ�е�����������ʧȥ���ӱ��������˵���缫Ϊ���������ʱ������̼�õ����ӵõ���ϩ��ˮ������ʽΪ��2CO2+12e-+12H+=C2H4+4H2O���ʴ�Ϊ��2CO2+12e-+12H+=C2H4+4H2O��

����Ŀ��25 ��ʱ�й����ʵ���ɫ���ܶȻ���Ksp�����±���
���� | AgCl | AgBr | AgI | Ag2S |
��ɫ | �� | ���� | �� | �� |
Ksp | 1.8��10��10 | 7.7��10��13 | 1.5��10��16 | 1.8��10��50 |
���������в���ȷ���ǣ�������
A.��AgCl�İ�ɫ����Һ�м���0.1 mol/L KI��Һ���л�ɫ��������
B.25 ��ʱ�����ñ��е��ܶȻ���Ksp�������Լ���AgCl��AgBr��AgI��Ag2S����ˮ��Һ��Ag����Ũ��
C.25 �棬AgCl����ֱ��ڵ����ʵ���Ũ��NaCl��CaCl2��Һ���ܽ�ﵽƽ�⣬����Һ�У�c��Ag+�����ܶȻ�����ͬ
D.��5 mL 1.8��10��6 mol/L NaCl��Һ�У�����1�Σ�20��ԼΪ1 mL��1��10��3 mol/L AgNO3��Һ�����ܲ�����ɫ����
����Ŀ���ߴ���������Ϊ�ϳ���������Ԫ�������ϵ�ԭ�ϣ���ҵ�Ͽ�����Ȼ�������̷������̿���Fe��Al��Mg��Zn��Ni��Si��Ԫ�أ��Ʊ�����������ͼ��ʾ���ش��������⣺
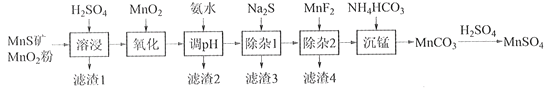
��ؽ�������[c0(Mn+)=0.1 mol��L1]�γ��������������pH��Χ���£�
�������� | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
��ʼ������pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
������ȫ��pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
��1��������1������S��__________________________��д�����ܽ����ж������������̷�Ӧ�Ļ�ѧ����ʽ____________________________________________________��
��2����������������������MnO2�������ǽ�________________________��
��3������pH��������������Һ��pH��ΧӦ����Ϊ_______~6֮�䡣
��4��������1����Ŀ���dz�ȥZn2+��Ni2+��������3������Ҫ�ɷ���______________��
��5��������2����Ŀ��������MgF2������ȥMg2+������Һ��ȹ��ߣ�Mg2+��������ȫ��ԭ����_____________________________________________________________________��
��6��д���������������ӷ���ʽ___________________________________________________��
��7����״��������Ԫ���Ͽ���Ϊ����ӵ���������ϣ��仯ѧʽΪLiNixCoyMnz2������Ni��Co��Mn�Ļ��ϼ۷ֱ�Ϊ+2��+3��+4����x=y=![]() ʱ��z=___________��
ʱ��z=___________��