题目内容
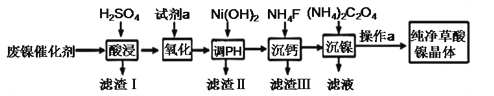
【题目】草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上用废镍催化剂(成分主要为Ni ,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
已知:①相关金属离子生成氢氧化物沉淀的pH见表中数据:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(NiC2O4)= 4.05×1010
(1)“酸浸”前将废镍催化剂粉碎的目的是:____。“滤渣Ⅰ”的主要成分为:____。
(2)若试剂a为H2O2 ,写出氧化时反应的离子方程式:____。
(3)调节pH的范围为:____。
(4)写出“沉钙”操作中加入NH4F时发生反应的离子方程式:____,NH4F的电子式为:____。
(5)如果“沉镍”操作后测得滤液中C2O42 的浓度为0.18 mol·L1,则溶液中c(Ni2+)= ____ mol·L1。
(6)将得到的草酸镍晶体在真空中加热至320℃分解,可重新制得单质镍催化剂。该制备过程的化学方程式为:____。
【答案】 增大接触面积,提高酸浸速率 SiO2 2Fe2++2H++H2O2=2Fe3++2H2O 5.0≤pH<6.8 (写为5.0~6.8亦可) Ca2++2F-=CaF2↓ 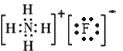 2.25×10-9 NiC2O4·2H2O=Ni+2CO2↑+2H2O
2.25×10-9 NiC2O4·2H2O=Ni+2CO2↑+2H2O
【解析】试题分析:(1)将废镍催化剂粉碎可以增大与酸的接触面积;Al2O3、Fe、SiO2、CaO中SiO2不与硫酸反应;(2)H2O2把Fe2+氧化为Fe3+;(3)根据流程图,调节pH的目的是除去Fe3+、Al3+;(4)加入NH4F的目的是生成氟化钙沉淀;NH4F是离子化合物;(5)根据Ksp(NiC2O4)= 4.05×1010计算c(Ni2+);(6)草酸镍晶体加热至320℃生成单质镍、二氧化碳、水;
解析:(1)将废镍催化剂粉碎可以增大与酸的接触面积,提高酸浸速率;Al2O3、Fe、SiO2、CaO中SiO2不与硫酸反应,所以“滤渣Ⅰ”的主要成分为SiO2;(2)H2O2把Fe2+氧化为Fe3+,反应的离子方程式是2Fe2++2H++H2O2=2Fe3++2H2O;(3)完全除去Fe3+、Al3+的最小PH是5.0,保证Ni2+不生成沉淀的PH小于6.8,所以PH 的范围是5.0≤pH<6.8;(4)加入NH4F的目的是生成氟化钙沉淀,反应的离子方程式是Ca2++2F-=CaF2↓;NH4F是离子化合物,电子式是 ;(5)根据Ksp(NiC2O4)= 4.05×1010,c(Ni2+)=
;(5)根据Ksp(NiC2O4)= 4.05×1010,c(Ni2+)=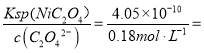 2.25×10-9;(6)草酸镍晶体加热至320℃生成单质镍、二氧化碳、水,反应方程式是NiC2O4·2H2O=Ni+2CO2↑+2H2O。
2.25×10-9;(6)草酸镍晶体加热至320℃生成单质镍、二氧化碳、水,反应方程式是NiC2O4·2H2O=Ni+2CO2↑+2H2O。