题目内容
【题目】铁是一种在生产和生活中应用广泛的金属元素。己知:
反应Ⅰ:Fe2O3(s)+ 3H2(g)=2Fe(s)+3H2O(g) ΔH1= +89 .6kJ /mol
反应Ⅱ:4Fe2O3(s)+Fe(s)=3Fe3O4(s) ΔH2=+2833.4kJ/mol
反应Ⅲ:Fe(s)+2HCl(g)![]() FeCl2(l)+H2(g) ΔH3
FeCl2(l)+H2(g) ΔH3
(1)反应Ⅰ的平衡常数表达式K=______________,该反应在高温下进行,最易生成的副产物是________________ (填化学式)。
(2)温度为T1时,恒容密闭容器中发生反应Ⅲ,反应时间与体系压强关系如图a所示,体系温度与HCl转化率关系如图b所示。
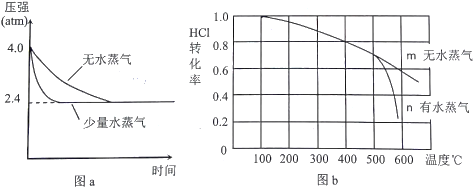
①分析图a,容器内通入少量水蒸气的作用是___________________。
②分析图b,ΔH3________0(填“>”、“<”或“=”),结合图a分析,T1=___________℃。
③分析图b,高于500℃后,曲线n发生的副反应热化学方程式为________________________________, 曲线n中HCl转化率明显降低的原因是____________________________________。
(3)①CaFeO4可制作半导体材料,向1L的高铁酸钠(Na2FeO4)溶液中加入0.0056g生石灰开始生成CaFeO4沉淀,原高铁酸钠溶液的物质的量浓度为________mol/L。已知Ksp(CaFeO4)=4.54×10-9,溶液体积变化忽略不计。
②用K2FeO4代替MnO2制备的碱性干电池(KOH做电解液)具有能量密度大、寿命长、无污染等优点,正极反应生成Fe2O3,写出正极的电极反应式______________________________。
【答案】 ![]() Fe3O4 催化剂 < 400 3Fe(s)+4H2O(g)= Fe3O4(s)+4H2(g) ΔH=+825.0 kJ/mol 副反应产生的H2使反应Ⅲ平衡左移,HCl(g)转化率下降 4.54×10-5 2FeO42-+6e-+5H2O=Fe2O3+10OH-
Fe3O4 催化剂 < 400 3Fe(s)+4H2O(g)= Fe3O4(s)+4H2(g) ΔH=+825.0 kJ/mol 副反应产生的H2使反应Ⅲ平衡左移,HCl(g)转化率下降 4.54×10-5 2FeO42-+6e-+5H2O=Fe2O3+10OH-
【解析】本题以铁为载体考查化学反应原理,涉及到的考点有平衡常数表达式、图像、Ksp的计算、电极反应式的书写等。(1)反应Ⅰ的平衡常数表达式K=![]() ;高温下反应时,生成的Fe与水蒸气反应生成Fe3O4,该反应在高温下进行,最易生成的副产物是Fe3O4;(2)①由图像a可知,加入少量水蒸气与未加入水蒸气相比,加入少量水蒸气时,反应III达到平衡时间短,故容器内通入少量水蒸气的作用是催化剂;②图b中随着温度升高,HCl的转化率减小,即升高温度,平衡向逆向移动,故ΔH3<0;分析图a可知,反应前的压强为4atm,平衡后的压强为2.4atm。设HCl的起始量为amol,则有:
;高温下反应时,生成的Fe与水蒸气反应生成Fe3O4,该反应在高温下进行,最易生成的副产物是Fe3O4;(2)①由图像a可知,加入少量水蒸气与未加入水蒸气相比,加入少量水蒸气时,反应III达到平衡时间短,故容器内通入少量水蒸气的作用是催化剂;②图b中随着温度升高,HCl的转化率减小,即升高温度,平衡向逆向移动,故ΔH3<0;分析图a可知,反应前的压强为4atm,平衡后的压强为2.4atm。设HCl的起始量为amol,则有:
Fe(s)+2HCl(g)![]() FeCl2(l)+H2(g)
FeCl2(l)+H2(g)
起始量/mol a 0
变化量/mol 2x x
平衡量/mol a-2x x
![]() ,则
,则![]() ,得x=0.4a,HCl的转化率为:
,得x=0.4a,HCl的转化率为:![]() ,结合图像b可知,此时温度为400℃;③根据图像b可知,温度高于500℃后,含有水蒸气的曲线n,HCl的转化率急剧降低,说明平衡向逆向反应,副反应产生氢气使平衡向逆向移动,HCl的转化率降低,故曲线n发生的副反应为铁与水蒸气在高温下反应生成四氧化三铁和氢气,将(反应II-反应I×4)÷3得曲线n发生的副反应热化学方程式为:3Fe(s)+4H2O(g)= Fe3O4(s)+4H2(g) ΔH=+825.0 kJ/mol;(3)①0.0056g生石灰加入1L高铁酸钠(Na2FeO4)溶液中,其c(Ca2+)=1×10-4mol/L,结合Ksp(CaFeO4)=4.54×10-9,得原高铁酸钠溶液的物质的量浓度为4.54×10-5mol/L;②根据题意可知,正极上发生反应的离子FeO42-还原为Fe2O3,结合溶液呈碱性可得电极反应式为:2FeO42-+6e-+5H2O=Fe2O3+10OH-。
,结合图像b可知,此时温度为400℃;③根据图像b可知,温度高于500℃后,含有水蒸气的曲线n,HCl的转化率急剧降低,说明平衡向逆向反应,副反应产生氢气使平衡向逆向移动,HCl的转化率降低,故曲线n发生的副反应为铁与水蒸气在高温下反应生成四氧化三铁和氢气,将(反应II-反应I×4)÷3得曲线n发生的副反应热化学方程式为:3Fe(s)+4H2O(g)= Fe3O4(s)+4H2(g) ΔH=+825.0 kJ/mol;(3)①0.0056g生石灰加入1L高铁酸钠(Na2FeO4)溶液中,其c(Ca2+)=1×10-4mol/L,结合Ksp(CaFeO4)=4.54×10-9,得原高铁酸钠溶液的物质的量浓度为4.54×10-5mol/L;②根据题意可知,正极上发生反应的离子FeO42-还原为Fe2O3,结合溶液呈碱性可得电极反应式为:2FeO42-+6e-+5H2O=Fe2O3+10OH-。

【题目】一定温度下,在三个体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)CH3OCH3(g)+H2O(g)
容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O | ||
Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是( )
A.该反应的正反应为放热反应
B.达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小
C.容器Ⅰ中反应到达平衡所需时间比容器Ⅲ中的长
D.若起始时向容器Ⅰ中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行
【题目】原子序数依次增加的前四周期的主族元素A~I,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H | I |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.197 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +2 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
(1)元素G在周期表中的位置是_______,元素C的气态氢化物的电子式为_______。
(2)元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有_______, E的单质晶体属于_______晶体(填“离子”、“分子”或“原子”),
(3)元素D、G、I的非金属性由强到弱的顺序是________(用元素符号表示),
(4)元素C、D的气态氢化物的稳定性顺序为_______(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为_______。
【题目】Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好pH和Fe2+浓度的废水中加入H2O2 , 所产生的羟基自由基能氧化降解污染物.现运用该方法降解有机污染物p﹣CP,探究有关因素对该降解反应速率的影响. [实验设计]控制p﹣CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比实验:
(1)请完成以下实验设计表:(表中不要留空格)
实验编号 | 实验目的 | T/K | pH | c/10﹣3 molL﹣1 | |
H2O2 | Fe2+ | ||||
① | 为以下实验作参照 | 298 | 3 | 6.0 | 0.30 |
② | 探究温度对降解反应速率的影响 | 3 | |||
③ | 298 | 10 | 6.0 | 0.30 | |
(2)[数据处理]实验测得p﹣CP的浓度随时间变化的关系如图: 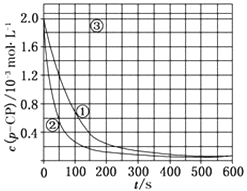
请根据上图实验①曲线,计算降解反应50~150s内的反应速率:v(p﹣CP)=molL﹣1s﹣1;
(3)[解释与结论] 实验①、②表明温度升高,降解反应速率增大.但后续研究表明:温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:;
(4)实验③得出的结论是:pH等于10时,反应(填“能”或“不能”)进行;
(5)[思考与交流] 实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来.根据上图中的信息,给出一种迅速停止反应的方法: .

