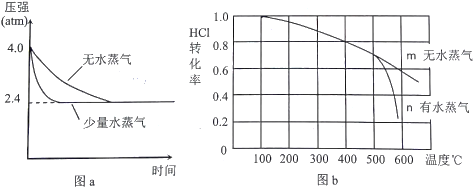
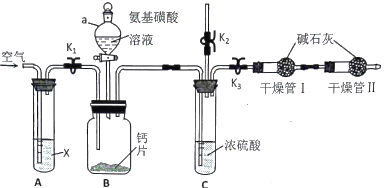
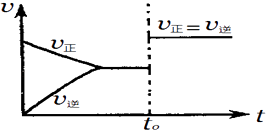
题目内容
【题目】原子序数依次增加的前四周期的主族元素A~I,有关性质如下:
元素代号 | A | B | C | D | E | F | G | H | I |
原子半径/nm | 0.037 | 0.074 | 0.073 | 0.071 | 0.143 | 0.102 | 0.099 | 0.197 | 0.114 |
主要化合价 | +1 | +5、-3 | -2 | -1 | +4、-4 | +6、-2 | +7、-1 | +2 | +7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
(1)元素G在周期表中的位置是_______,元素C的气态氢化物的电子式为_______。
(2)元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有_______, E的单质晶体属于_______晶体(填“离子”、“分子”或“原子”),
(3)元素D、G、I的非金属性由强到弱的顺序是________(用元素符号表示),
(4)元素C、D的气态氢化物的稳定性顺序为_______(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为_______。
【答案】 第三周期ⅦA族 ![]() 离子键、共价键 原子 F﹥ Cl﹥ Br HF﹥H2O 2H2O + 2F2 = 4HF + O2
离子键、共价键 原子 F﹥ Cl﹥ Br HF﹥H2O 2H2O + 2F2 = 4HF + O2
【解析】根据表格数据,D、G、I的最低负价均为-1价,其中G、I有+7价,则D为F元素;I的原子半径大于G,则G为Cl元素,I为Br元素。E存在+4和-4价,为第ⅣA族元素,E的单质是一种常见的半导体材料,为Si元素。F的原子序数大于E,小于G,则F为S元素;H的原子序数大于G,化合价为+2价,则H为Ca元素。根据BC的原子序数的关系和原子半径的大小可知,B为N元素,C为O元素,则A为H元素。
根据上述分析可知,A为H元素,B为N元素,C为O元素,D为F元素,E为Si元素,F为S元素,G为Cl元素,H为Ca元素,I为Br元素。
(1)元素G为Cl元素,在周期表中位于第三周期,第ⅦA族,元素C的气态氢化物为水,电子式为![]() ,故答案为:第三周期,第ⅦA族;
,故答案为:第三周期,第ⅦA族;![]() ;
;
(2)元素A、B、G可形成化合物NH4Cl,为铵盐属于离子化合物,该化合物中存在的化学键有离子键、共价键;硅晶体为空间网状结构的晶体,属于原子晶体,故答案为:离子键、共价键;原子;
(3)同一主族,从上到下,非金属性减弱,同一周期,从左向右,非金属性增强。元素D、G、I的非金属性由强到弱的顺序为F﹥ Cl﹥ Br,故答案为:F﹥ Cl﹥ Br;
(4)同一周期,从左向右,非金属性增强,则对应氢化物的稳定性增强。元素C、D的气态氢化物的稳定性顺序为HF﹥H2O,元素D的单质可以将元素C从化合物H2O中置换出来,反应的化学方程式为2H2O + 2F2 = 4HF + O2,故答案为:HF﹥H2O; 2H2O + 2F2 = 4HF + O2。