题目内容
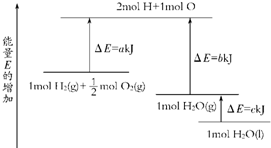
一定条件下,化学反应2H2+O2═2H2O的能量变化如图所示,则反应的热化学方程式可表示为( )

A.H2(g)+
| ||
| B.2H2(g)+O2(g)═2H2O(g)△H=2(b-a)kJ?mol-1 | ||
C.H2(g)+
| ||
| D.2H2(g)+O2(g)═2H2O(l)△H=2(a-b-c)kJ?mol-1 |
由图中分析判断,1molH2(g)+
molO2(g)的能量为aKJ,1molH2O(g)的能量为bKJ,所以H2(g)+
O2(g)═H2O(g)△H=(a-b) kJ?mol-1,
1molH2O(g)转化为1molH2O(l)放热为cKJ,所以得到:H2(g)+
O2(g)═H2O(l)△H=(a-b-c) kJ?mol-1;
即2H2(g)+O2(g)═2H2O(l)△H=2(a-b-c) kJ?mol-1,
故选D.
| 1 |
| 2 |
| 1 |
| 2 |
1molH2O(g)转化为1molH2O(l)放热为cKJ,所以得到:H2(g)+
| 1 |
| 2 |
即2H2(g)+O2(g)═2H2O(l)△H=2(a-b-c) kJ?mol-1,
故选D.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案
相关题目