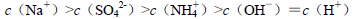题目内容
用CH4催化还原NOx可以消除氮氧化物的污染.例如:
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为______,写出上述反应的热化学方程式:______.
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ?mol-1
若用标准状况下4.48LCH4还原NO2至N2,整个过程中转移的电子总数为______,写出上述反应的热化学方程式:______.
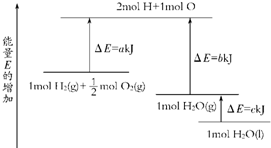
已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ?mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ?mol-1,
利用盖斯定律将
可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-
kJ?mol-1=867kJ?mol-1,
n(CH4)=0.2mol,整个过程中转移的电子总数为0.2mol×8NA=1.6NA=9.6×1023,
故答案为:9.6×1023或1.6NA;CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1.
利用盖斯定律将
| ①+② |
| 2 |
| 574+1160 |
| 2 |
n(CH4)=0.2mol,整个过程中转移的电子总数为0.2mol×8NA=1.6NA=9.6×1023,
故答案为:9.6×1023或1.6NA;CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g)△H=-867kJ?mol-1.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

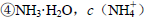 由大到小的顺序是
由大到小的顺序是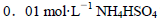 溶液中滴加NaOH溶液至中性:
溶液中滴加NaOH溶液至中性: