题目内容
【题目】运用化学反应原理研究碳、氮、硫的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
I.氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a. CH4(g)+H2O(g)CO(g)+3H2(g) H1=+216.4kJ/mol
b. CO(g)+H2O(g)CO2(g)+H2(g) H2=-41.2kJ/mol
则反应CH4(g)+2H2O(g)CO2(g)+4H2(g) H=___。
(2)起始时投入氮气和氢气的物质的量分别为1mol、3mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。
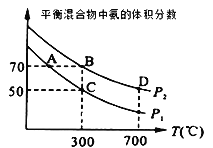
①恒压时,反应一定达到平衡状态的标志是___(填序号)
A. N2和H2的转化率相等 B. 反应体系密度保持不变
C. ![]() 保持不变 D.
保持不变 D. ![]() =2
=2
②P1___P2 (填“>”“=”或“<”,下同);反应的平衡常数:B点___D点。
③C点H2的转化率为__;
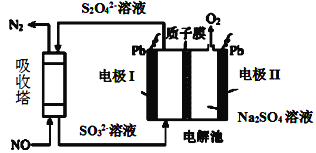
Ⅱ.用间接电化学法去除烟气中NO的原理如图所示。
(3)已知阴极室溶液呈酸性,则阴极的电极反应式为____。反应过程中通过质子膜的H+为2mol时,吸收塔中生成的气体在标准状况下的体积为____L。
【答案】+175.2kJ/mol BC < > 66.7% 2SO32-+4H++2e-=S2O42-+2H2O 11.2
【解析】
(1)由a+b,可得CH4(g)+2H2O(g)CO2(g)+4H2(g) △H=(+216.4-41.2)kJ/mol=+175.2kJ/mol;
答案为+175.2kJ/mol;
(2)①A、 N2和H2的起始物料比为1:3,且按照1:3反应,则无论是否达到平衡状态,转化率都相等,N2和H2转化率相等不能用于判断是否达到平衡状态,A错误;
B、气体的总质量不变,由于该反应的正反应是气体体积减小的反应,恒压条件下,当反应体系密度保持不变时,说明体积不变,则达到平衡状态,B正确;
C、![]() 保持不变,说明氢气、氨气的浓度不变,反应达到平衡状态,C正确;
保持不变,说明氢气、氨气的浓度不变,反应达到平衡状态,C正确;
D、达平衡时各物质的浓度保持不变,但不一定等于化学计量数之比,![]() =2不能确定反应是否达到平衡状态,D错误;
=2不能确定反应是否达到平衡状态,D错误;
答案为BC;
②由于该反应的正反应是气体体积减小的反应,增大压强,平衡正向移动,平衡混合气体中氨气的百分含量增大,由图象可知P1<P2,该反应的正反应是放热反应,升高温度,平衡逆向移动,平衡常数减小,则反应平衡常数:B点>D点;
答案为<;>;
③起始时投入氮气和氢气分别为1mol、3mol,反应的方程式为N2(g)+3H2(g)2NH3(g),C点氨气的含量为50%,设转化N2物质的量为xmol,则
N2(g) +3H2(g) 2NH3(g)
起始:1mol 3mol 0
转化:x mol 3xmol 2xmol
平衡:(1-x)mol (3-3x)mol 2xmol
则![]() ×100%=50%,解得x=
×100%=50%,解得x=![]() ,则C点H2的转化率为
,则C点H2的转化率为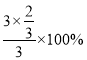 =66.7%;
=66.7%;
答案为66.7%;
II. 阴极通入的SO32-发生得电子的还原反应生成S2O42-,则阴极反应式为:2SO32-+4H++2e-=S2O42-+2H2O;电解池的阳极水电离出的氢氧根离子放电生成氧气,发生反应为:2H2O-4e-=4H++O2↑,则电解池中总反应为:4SO32-+4H+![]() 2S2O42-+2H2O+O2↑,即转移4mol电子时有4mol氢离子通过质子交换膜,则反应过程中通过质子膜的H+为2mol时,转移电子的物质的量为2mol,生成1molS2O42-,图示NO吸收塔中S2O42-失去电子被氧化成SO32-,NO得到电子被还原成N2,根据得失电子守恒可知,吸收柱中生成N2的物质的量为:n(N2)=
2S2O42-+2H2O+O2↑,即转移4mol电子时有4mol氢离子通过质子交换膜,则反应过程中通过质子膜的H+为2mol时,转移电子的物质的量为2mol,生成1molS2O42-,图示NO吸收塔中S2O42-失去电子被氧化成SO32-,NO得到电子被还原成N2,根据得失电子守恒可知,吸收柱中生成N2的物质的量为:n(N2)=![]() =0.5mol,标况下0.5mol氮气的体积为:11.2L。
=0.5mol,标况下0.5mol氮气的体积为:11.2L。
答案为2SO32-+4H++2e-=S2O42-+2H2O;11.2L。

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案