题目内容
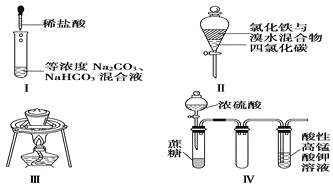
【题目】常温时,有以下试剂:①蒸馏水②0.01mol/L的盐酸③pH=12的氨水④pH=11的碳酸钠溶液,上述溶液中由水电离的c(H+)关系正确的是( )
A.②>①
B.③>④
C.①>④
D.②=③
【答案】D
【解析】解:酸溶液中,氢氧根离子是水电离,碱溶液中氢离子是水电离的.
①蒸馏水中,氢离子和氢氧根均全部来自于水的电离,故由水电离的c(H+)=10﹣7mol/L;
②0.01mol/L盐酸,溶液中氢离子浓度为0.01mol/L,主要来自于水的电离,氢氧根全部来自于水的电离,故水电离的氢氧根离子为: ![]() mol/L=1×10﹣12mol/L;
mol/L=1×10﹣12mol/L;
③pH=12的氨水中,氢离子全部来自于水的电离,氢氧根几乎全部来自于水的电离,故溶液中水电离出的氢离子浓度为1×10﹣12mol/L;
④pH=11的碳酸钠溶液中,c(H+)=10﹣11mol/L,c(OH﹣)=10﹣3mol/L,由于碳酸根能结合水电离出的氢离子,故氢氧根的浓度能代表水电离出的全部氢氧根,故溶液中由水电离出的氢原子的浓度为1×10﹣3mol/L.
所以由水电离产生的c(H+)④>①>②=③,故选D.

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | ﹣ |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理?_____(填“合理”或“不合理”)。
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是________,反应的离子方程式为_____________________。
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是_________(填序号)。
A、浓硫酸 B、稀硫酸 C、稀硝酸 D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出,此时溶液中氮元素的存在形式只有NO3-和NH4+,铁元素的存在形式为Fe3+,在反应结束后的溶液中,逐滴加入6molL﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:

(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式:___________;
(2)在CD段,沉淀的物质的量减少,则此阶段发生反应的离子方程式为________________;
(3)熔融物中铝元素的物质的量为_______mol。
(4)B点对应的沉淀的物质的量为____mol。
【题目】CO、NO2等有毒气体的转化以及氮的化合物合成、应用及氮的固定一直是科学研究的热点。
(1)以CO2与NH3为原料合成化肥尿素[CO(NH2)2]的主要反应如下:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H= -159.47kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=akJ·mol-1
③2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g) △H= -86.98kJ·mol-1
则a=_______。
(2)反应2NH3(g)+CO2(g)![]() CO(NH2)2(1)+H2O(g),在合成塔中进行。右图中I、II、III三条曲线为合成塔中按不同氨碳比和水碳比投料时二氧化碳转化率的情况。曲线I、II、III水碳比的数值分别为:
CO(NH2)2(1)+H2O(g),在合成塔中进行。右图中I、II、III三条曲线为合成塔中按不同氨碳比和水碳比投料时二氧化碳转化率的情况。曲线I、II、III水碳比的数值分别为:
I.0.6~0.7 II.1~1.1 III.1.5~1.61
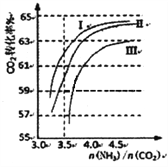
生产中应选用水碳比的数值为__________(选填序号)。
(3)4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 ,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是_____(填代号)。
4CO2(g)+N2(g) ΔH=-1200 kJ·mol-1 ,对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是_____(填代号)。
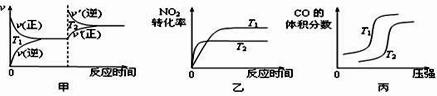
(4)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g) ![]() N2(g)+CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①30min后,只改变某一条件,根据上表的数据判断改变的条件可能是_______(填字母代号)。
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则达到新平衡时NO的转化率_________(填“升高”或“降低”),ΔH___________0(填“>”或“<”).
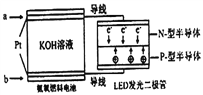
(5)一种氨燃料电池,使用的电解质溶液是2mol/L的KOH溶液。电池反应为:4NH3+3O2=2N2+6H2O;请写出通入a气体一极的电极反应式为____________________