题目内容
5.为验证木炭与浓硫酸反应的产物中有二氧化碳和二氧化碳,选用图中的仪器(含所盛物质)组装成套实验装置,回答下列问题.(提示:酸性KMnO4溶液能吸收SO2气体)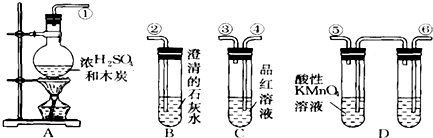
(1)写出A中反应的化学方程式:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H20.
(2)在实验进行中,按气流方向从左到右的顺序,导管口的连接顺序应该是①④③⑥⑤②.
(3)证明产物中有SO2的现象分别为A中的品红溶液褪色.
(4)证明产物中有CO2的现象分别为D中品红溶液不褪色,B中出现白色浑浊.
分析 (1)浓硫酸的强氧化性,在加热条件下能够与碳反应生成二氧化碳、二氧化硫气体和水;
(2)二氧化硫和二氧化碳都能够使澄清石灰水变浑浊,需要先检验二氧化硫,然后用酸性高锰酸钾溶液除去二氧化硫,最后检验二氧化碳,据此连接装置;
(3)二氧化硫检验漂白性,能够使品红溶液褪色;
(4)D中品红溶液不褪色,证明二氧化硫已经除尽,若B中石灰水变浑浊,则证明存在二氧化碳.
解答 解:(1)浓硫酸具有强氧化性,在加热条件下回合木炭发生氧化还原反应,生成二氧化碳、二氧化硫、水,反应的化学方程式为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H20,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+SO2↑+2H20;
(2)由于二氧化硫和二氧化碳都能够与澄清石灰水反应生成沉淀,所以应该先用品红溶液检验二氧化硫,然后用酸性高锰酸钾溶液除去二氧化硫,再用品红溶液检验二氧化硫是否除尽,最后用澄清石灰水检验二氧化碳,所以连接顺序为:①④③⑥⑤②,
故答案为:①④③⑥⑤②;
(3)二氧化硫检验漂白性,若A中的品红溶液褪色,证明混合气体中含有二氧化硫,
故答案为:A中的品红溶液褪色;
(4)证明二氧化碳的存在,首先必须证明二氧化硫已经除尽,所以若D中品红溶液不褪色,B中出现白色浑浊,则说明混合气体中含有二氧化碳气体,
故答案为:D中品红溶液不褪色,B中出现白色浑浊.
点评 本题考查了浓硫酸的化学性质,题目难度中等,注意掌握浓硫酸具有的性质,在检验二氧化碳、二氧化硫的混合气体时,必须明确检验的先后顺序及使用的试剂、出现的现象.

练习册系列答案
 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案
相关题目
17.在下列条件下,两瓶气体所含的原子数一定相等的是( )
| A. | 具有同质量、不同体积的N2O和CO2 | B. | 具有同温度、同体积的CO和N2 | ||
| C. | 具有同体积、同密度的SO2和NO2 | D. | 具有同密度、不同质量的O2和O3 |
15.向a mol BaCl2、AlCl3和FeCl3的混合液A中,逐滴加入Na2SO4和NaOH的混合液B,产生沉淀的物质的量n与加入溶液B的体积关系如图所示,下列叙述正确的是( )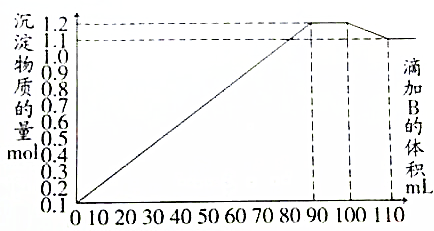

| A. | 加入90mL B时,A溶液中金属离子沉淀完全 | |
| B. | 加入110mL B时,沉淀物仅为BaSO4 | |
| C. | B溶液中Na2SO4和NaOH的物质的量浓度之比为1:1 | |
| D. | 当溶液中含有NaAlO2时,加入溶液B的体积V(B)≥100mL |
2.下列说法正确的是( )
| A. | 按系统命名法,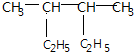 的名称是2,3-二乙基丁烷 的名称是2,3-二乙基丁烷 | |
| B. | 主链有4个碳原子,且总碳原子数≤6的烷烃共有10种 | |
| C. | 结构片段为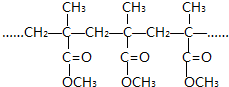 的高聚物,是由其单体通过缩聚反应生成的 的高聚物,是由其单体通过缩聚反应生成的 | |
| D. | 等质量的乙烯和聚乙烯完全燃烧,产生的二氧化碳的质量比为1:1 |
10. 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.
(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
①从起始经过5min达到化学平衡时,用生成物CO2表示该反应的反应速率v(CO2)=0.01mol/(L.min);平衡时,容器中CO的转化率为50%.
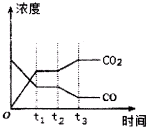
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
②相同温度下,某汽车尾气中CO、CO2的浓度分别为l.0×10-5mol/L和1.0×l0-4mol/L.若在汽车的排气管上增加一个补燃器,不断补充O2并使其浓度保持为1.0×l0-4mol/L,则最终尾气中CO的浓度为1.1×10-6mol/L(请保留两位有效数字).
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.(1)将CO和气态水通入一个体积固定的密闭容器中,在一定条件下发生如下可逆反应:CO(g)+H2O(g)?CO2(g)+H2(g),△H<0,800℃,在2L恒容密闭容器中,起始时按照下表数据进行投料,达到平衡状态,K=l.0.
| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
②如图表示上述反应在tl时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况.则t2时刻发生改变的条件可能是降低温度或降低H2浓度或增大H2O(g)浓度.(写出一条)
(2)汽车尾气中的一氧化碳是大气污染物,可通过反应:CO(g)+$\frac{1}{2}$O2(g)?CO2(g)降低其浓度.
①某温度下,在两个容器中进行上述反应,容器中各物质的起始浓度及正逆反应速率关系如下表所示.请在表中的空格处填写“>““<”或“=“.
| 容器编号 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
(3)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其KSp=2.8×l0-9.现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为2×l0-4mol/L,则生成CaCO3沉淀所需CaCl2溶液的最小浓度为5.6×10-5mol/L.
17.化学与社会、生产、生活紧切相关,下列说法正确的是( )
| A. | 信息产业中的光缆的主要成份是单质硅 | |
| B. | NO2、CO2、SO2、PM2.5颗粒都会导致酸雨 | |
| C. | 高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强 | |
| D. | 发酵粉能使焙制出的糕点疏松多孔,是因为发酵粉中含有碳酸氢钠 |
15.如图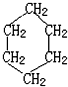 是环己烷的结构简式,下列说法不正确的是( )
是环己烷的结构简式,下列说法不正确的是( )
 是环己烷的结构简式,下列说法不正确的是( )
是环己烷的结构简式,下列说法不正确的是( )| A. | 环己烷不属于烃 | |
| B. | 环己烷的分子式为C6H12 | |
| C. | 环己烷是苯和氢气加成产物 | |
| D. | 1 mol环己烷完全燃烧消耗氧气的物质的量为9 mol |
 A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示).
A~G为原子序数依次增大的短周期主族元素,A原子与其他元素不处于同一周期,元素B的基态原子核外电子共有6种运动状态,D、F同族,D原子的基态原子价电子排布式均为ns2npn+2,E元素所在周期中,E气态基态原子的第一电离能力最小,试回答下列问题:(均用元素符号表示). (Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等. .
.