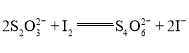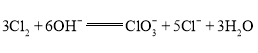题目内容
【题目】含碳化合物在生产生活中广泛存在。请回答下列问题:
(1)Andren Dasic等提出在金属催化剂M的作用下以![]() 为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图1所示。(物质与氧原子的结合力用
为氧化剂可以氧化乙烯生成乙醛,催化体系氧化还原循环如图1所示。(物质与氧原子的结合力用![]() 表示),氧原子与
表示),氧原子与![]() 生成
生成![]() 的结合力
的结合力![]() ,氧原子与乙烯生成乙醛的结合力
,氧原子与乙烯生成乙醛的结合力![]() ,则可做该反应催化剂的金属M与氧原子的结合力
,则可做该反应催化剂的金属M与氧原子的结合力![]() (M)的值应满足_______。使用催化剂会使该反应的活化能______(填“增大”、“减小”、“不变”)。
(M)的值应满足_______。使用催化剂会使该反应的活化能______(填“增大”、“减小”、“不变”)。

(2)已知![]() 、
、![]() 、
、![]() 的燃烧热分别为
的燃烧热分别为![]() 、
、![]() 、
、![]() 。
。
则反应:![]() ΔH=_________。
ΔH=_________。
(3)已知在含少量的![]() 溶液中,反应
溶液中,反应![]() 分两步进行:第Ⅰ步反应
分两步进行:第Ⅰ步反应![]() (慢反应),第Ⅱ步为快反应。
(慢反应),第Ⅱ步为快反应。
①请写出第二步反应的化学方程式:____________。
②增大浓度![]() 浓度______(填“能”或“不能”)明显增大总反应的平均速率,理由为__________。
浓度______(填“能”或“不能”)明显增大总反应的平均速率,理由为__________。
(4)某密闭容器中发生:![]() ,
,![]() 在不同温度下平衡分解的情况如图2所示。
在不同温度下平衡分解的情况如图2所示。


①图中a、b、c三点的平衡常数![]() 的大小关系为_____________。
的大小关系为_____________。
②恒温恒容条件下,能表示该可逆反应达到平衡状态的是____________(填标号)
A.![]() 体积分数与
体积分数与![]() 体积分数的比值保持不变
体积分数的比值保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.容器内碳元素的质量分数保持不变
③为实现![]() 减排,目前较成熟的方法是用高浓度的
减排,目前较成熟的方法是用高浓度的![]() 溶液吸收工业烟气中的
溶液吸收工业烟气中的![]() ,得溶液X,再利用电解法使
,得溶液X,再利用电解法使![]() 溶液再生,其装置示意图如图3,简述
溶液再生,其装置示意图如图3,简述![]() 在阴极区再生的原理_______。
在阴极区再生的原理_______。
【答案】![]() 减小
减小 ![]()
![]() 能 总反应的平均速率由慢反应决定,
能 总反应的平均速率由慢反应决定,![]() 是慢反应的反应物,增大
是慢反应的反应物,增大![]() 的浓度,慢反应速率增大,总反应的平均速率增大(或
的浓度,慢反应速率增大,总反应的平均速率增大(或![]() 是总反应的催化剂,增大
是总反应的催化剂,增大![]() 的浓度,总反应的平均速率增大)
的浓度,总反应的平均速率增大) ![]() C
C ![]() 存在电离平衡:
存在电离平衡:![]() ,阴极
,阴极![]() 放电,
放电,![]() 浓度减小,平衡右移(或溶液中
浓度减小,平衡右移(或溶液中![]() 放电,增大了
放电,增大了![]() 浓度,
浓度,![]() 与
与![]() 反应生成了
反应生成了![]() ,从而使
,从而使![]() 再生)
再生)
【解析】
由催化剂的作用机理结合图示信息知,当氧原子与催化剂的结合力处于中间值时,此反应可发生,催化剂会降低反应的活化能;根据盖斯定律求反应热,先分别写出燃烧热的热反应方程式,再用第3个的热反应方程式减去第1个和第2个的热反应方程式;根据第I步反应和催化剂的反应原理,总反应减去第I步反应得到第Ⅱ步反应的化学方程式;总反应速率由慢反应速率决定,![]() 是慢反应的反应物,因此增大
是慢反应的反应物,因此增大![]() 的浓度能明显增大总反应的平均速率;温度相同,化学平衡常数不变,温度升高由图观察平衡的移动方向,比较平衡常数;平衡状态的判断通过浓度不再改变、正反应速率等于逆反应速率和其它变量不再改变来判断。
的浓度能明显增大总反应的平均速率;温度相同,化学平衡常数不变,温度升高由图观察平衡的移动方向,比较平衡常数;平衡状态的判断通过浓度不再改变、正反应速率等于逆反应速率和其它变量不再改变来判断。
(1) 氧原子与N生成NO的结合力![]() ,氧原子与乙烯生成乙醛的结合力
,氧原子与乙烯生成乙醛的结合力![]() ,由催化剂的作用机理结合图示信息知,当氧原子与催化剂的结合力处于中间值时,此反应可发生,因此可用作该反应催化剂的金属M与氧原子的结合力OA(M)的值应满足
,由催化剂的作用机理结合图示信息知,当氧原子与催化剂的结合力处于中间值时,此反应可发生,因此可用作该反应催化剂的金属M与氧原子的结合力OA(M)的值应满足![]() ;催化剂会降低反应的活化能;故答案为:
;催化剂会降低反应的活化能;故答案为:![]() ,减小;
,减小;
(2)已知![]() 、
、![]() 、
、![]() 的燃烧热分别为
的燃烧热分别为![]() 、
、![]() 、
、![]() ,则热反应方程式分别为:
,则热反应方程式分别为:
CO(g)+![]() O2(g)=CO2(g)ΔH=
O2(g)=CO2(g)ΔH=![]()
CH4(g)+2O2(g)=CO2(g)+2H2O(l)ΔH=![]()
CH3CHO(l)+![]() O2(g)=2CO2(g)+2H2O(l)ΔH=
O2(g)=2CO2(g)+2H2O(l)ΔH=![]()
将第3个的热反应方程式减去第1个和第2个的热反应方程式,得反应![]() ,则反应热ΔH=
,则反应热ΔH=![]() ;
;
(3) ①根据第Ⅰ步反应和催化剂的反应原理,总反应减去第Ⅰ步反应得到第Ⅱ步反应的化学方程式![]() ;
;
②总反应速率由慢反应速率决定,![]() 是慢反应的反应物,因此增大
是慢反应的反应物,因此增大![]() 的浓度能明显增大总反应的平均速率,故答案为:能;总反应的平均速率由慢反应决定,
的浓度能明显增大总反应的平均速率,故答案为:能;总反应的平均速率由慢反应决定,![]() 是慢反应的反应物,增大
是慢反应的反应物,增大![]() 的浓度,慢反应速率增大,总反应的平均速率增大(或
的浓度,慢反应速率增大,总反应的平均速率增大(或![]() 是总反应的催化剂,增大
是总反应的催化剂,增大![]() 的浓度,总反应的平均速率增大)
的浓度,总反应的平均速率增大)
(4)①a和b温度相同,即平衡常数![]() ,c点时,温度升高,根据图2二氧化碳体积分数减小,则平衡正向移动,K增大,所以
,c点时,温度升高,根据图2二氧化碳体积分数减小,则平衡正向移动,K增大,所以![]() 。
。
②A.根据方程式可知,一氧化碳与氧气的物质的量之比为2:1,即![]() 体积分数与
体积分数与![]() 体积分数的比值一直都是2:1,不能说明是否达到平衡状态,当
体积分数的比值一直都是2:1,不能说明是否达到平衡状态,当![]() 体积分数与
体积分数与![]() 体积分数不变改变可以,A不符合题意;
体积分数不变改变可以,A不符合题意;
B. 恒容,体积不变,反应前后质量守恒,质量也保持不变,则密度一直保持不变, B不符合题意;
C. 平均摩尔质量等于总质量除以总物质的量,气体总质量一直不变,但是这个反应是气体个数减少的反应,即气体的总物质的量可变,所以容器内混合气体的平均摩尔质量保持不变能说明达到平衡状态,C符合题意;
D. 容器内碳元素的质量一直不变,容器内物质的总质量也不变,即碳元素的质量分数一直保持不变,D不符合题意。
答案选C。
③![]() 被
被![]() 吸收生成
吸收生成![]() ,实现了减排,电解时阴极H+得电子生成氢气,使平衡
,实现了减排,电解时阴极H+得电子生成氢气,使平衡![]() 向右移动,
向右移动,![]() 增多,所以答案为:
增多,所以答案为:![]() 存在电离平衡:
存在电离平衡:![]() ,阴极
,阴极![]() 放电,
放电,![]() 浓度减小,平衡右移(或溶液中
浓度减小,平衡右移(或溶液中![]() 放电,增大了
放电,增大了![]() 浓度,
浓度,![]() 与
与![]() 反应生成了
反应生成了![]() ,从而使
,从而使![]() 再生)。
再生)。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案