题目内容
【题目】将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)=0.3 mol/L。试计算:(本题无计算过程不给分)
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。______
(2)溶液稀释后,c(H+)是多少?__________
【答案】4.48L 0.84mol/L
【解析】
有关化学方程式:
① CuO + H2SO4= CuSO4+ H2O
② Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
设混合物中Cu的物质的量为x,CuO的物质的量为y。
有: 64x+ 80y=20.8…………………………①
x+y=0.3………………………………②
解得:x=0.2mol y=0.1mol
(1)V(SO2)=0.2mol×22.4L/mol = 4.48L
(2)已知n(H2SO4)总=0.05L×18.4mol/L=0.92mol
n(H2SO4)反应=2x+y=0.5mol
n(H2SO4)余=0.92mol-0.5mol=0.42mol
故溶液稀释后,c(H+)是![]() =0.84mol/L;
=0.84mol/L;
答:(1)反应过程中放出的气体在标准状况下的体积为4.48L;
(2)溶液稀释后,c(H+)是0.84mol/L。

【题目】异丁烯![]() 是一种重要的化工原料,可由异丁烷
是一种重要的化工原料,可由异丁烷![]() 直接催化脱氢制备:
直接催化脱氢制备:
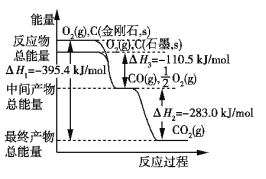
(1)已知:![]()
![]()
写出由异丁烷![]() 催化脱氢制备异丁烯
催化脱氢制备异丁烯![]() 的热化学方程式。_________。
的热化学方程式。_________。
(2)一定条件下,以异丁烷为原料催化脱氢生产异丁烯。温度、压强的改变对异丁烷平衡转化率的影响如图所示。
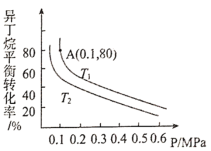
①判断![]() 、
、![]() 的大小关系:
的大小关系:![]() _____________
_____________![]() (填“>”或“<”);能使单位时间内异丁烯的产量提高,又能使异丁烷平衡产率提高,应采取的措施是____________(填标号)。
(填“>”或“<”);能使单位时间内异丁烯的产量提高,又能使异丁烷平衡产率提高,应采取的措施是____________(填标号)。
a.升高温度 b.降低温度 c.增大压强 d.降低压强 e.使用催化剂
②平衡常数的表达式中的平衡浓度可以用平衡时各气体的分压代替(气体a的分压=气体a的物质的量分数×总压强,即![]() (总)。求图中的A点状态下的异丁烷脱氢反应的平衡常数
(总)。求图中的A点状态下的异丁烷脱氢反应的平衡常数![]() _____________(保留两位有效数字)。
_____________(保留两位有效数字)。
(3)温度对催化剂的活性和目标产物的选择性都有一定的影响。下表是以![]() 为催化剂,在反应时间相同时,测得的不同温度下的数据。
为催化剂,在反应时间相同时,测得的不同温度下的数据。
温度/℃ | 550 | 570 | 590 | 610 | 630 |
异丁烷转化率/% | 13.8 | 24.5 | 25.6 | 30.0 | 33.3 |
异丁烯选择性/% | 93.9 | 88.3 | 95.0 | 80.4 | 71.2 |
异丁烯的产率/% | 12.9 | 21.6 | w | 24.1 | 23.7 |
已知①选择性![]() ;②异丁烷高温下裂解生成短碳链烃类化合物
;②异丁烷高温下裂解生成短碳链烃类化合物
①590℃时异丁烯的产率![]() _____________×100%。
_____________×100%。
②在590℃之前异丁烯的产率随温度升高而增大的原因可能是____________、_____________。
③590℃之后,异丁烯产率降低的主要原因可能是_____________。