题目内容
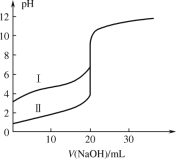
【题目】下面四种变化中,有一种变化与其他三种变化类型不同的是( )
A.CH3CH2OH + CH3COOH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
B.CH3CH2Br+NaOH ![]() CH2=CH2↑+NaBr+H2O
CH2=CH2↑+NaBr+H2O
C.2CH3CH2OH![]() CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.CH3CH2OH + HBr→CH3CH2Br + H2O
【答案】B
【解析】
A、乙醇和乙酸在浓硫酸作催化剂的作用下,发生酯化反应生成乙酸乙酯,也为取代反应;
B、卤代烃在NaOH的醇溶液中发生消去反应得到烯烃;
C、乙醇在浓硫酸作催化剂下,140℃下,发生取代反应,得到乙醚;
D、乙醇中的—OH被Br原子取代,到卤代烃,发生取代反应;
综上只有B为消去反应,其他为取代反应;
答案选B。

 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
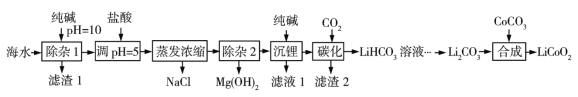
已知如下信息:①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
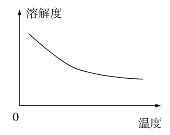
②碳酸锂的溶解度与温度关系如图所示。
③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为____________ ,滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和____________________(填化学式)。
(2)调pH=5的目的是________________________。
(3) “沉锂”包括过滤、洗涤等,宜用_____________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 | n(Na2CO3)/n(LiCl) | 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 0.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______________(填序号)方案投料。
(4) “除杂2”中调pH=13时c(Mg2)=_______________mol·L1。
(5) “合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式_____________________________________________。
【题目】下列实验方案的设计能达到相应实验目的的是( )
选项 | 实验目的 | 实验方案 |
A | 验证 | 向 |
B | 比较HF与 | 常温下,用pH试纸分别测定浓度均为 |
C | 验证 | 向 |
D | 比较Fe与Cu的金属活动性 | 常温下,将Fe、Cu与浓硝酸组成原电池 |
A.AB.BC.CD.D