题目内容
【题目】LiCoO2(钴酸锂)是锂离子电池的正极材料。以某海水为原料制备钴酸锂的一种流程如下:
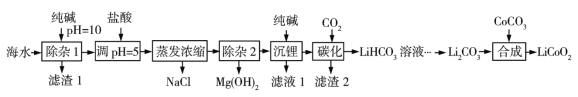
已知如下信息:①该海水中含浓度较大的LiCl,含少量MgCl2、CaCl2、MnCl2等。
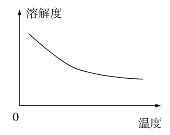
②碳酸锂的溶解度与温度关系如图所示。
③常温下,几种难溶物质的溶度积数据如下:
物质 | Li2CO3 | MgCO3 | CaCO3 | MnCO3 | Mg(OH)2 |
Ksp | 2.5×102 | 6.8×106 | 2.8×109 | 2.3×1011 | 6.0×1010 |
请回答下列问题:
(1)LiCoO2中钴的化合价为____________ ,滤渣1主要成分有MgCO3、Mg(OH)2、CaCO3和____________________(填化学式)。
(2)调pH=5的目的是________________________。
(3) “沉锂”包括过滤、洗涤等,宜用_____________(填“热水”或“冷水”)洗涤Li2CO3。加入纯碱的量与锂回收率的关系如表所示:
序号 | n(Na2CO3)/n(LiCl) | 沉淀质量/g | 碳酸锂含量/% | 锂回收率/% |
① | 0.9∶1 | 10.09 | 92.36 | 77.67 |
② | 1.0∶1 | 0.97 | 90.19 | 82.46 |
③ | 1.1∶1 | 11.45 | 89.37 | 85.27 |
④ | 1.2∶1 | 12.14 | 84.82 | 85.45 |
从生产成本考虑,宜选择_______________(填序号)方案投料。
(4) “除杂2”中调pH=13时c(Mg2)=_______________mol·L1。
(5) “合成”中采用高温条件,放出一种能使澄清石灰水变浑浊的气体。写出“合成”发生反应的化学方程式_____________________________________________。
【答案】+3 MnCO3 除去过量的Na2CO3,避免蒸发浓缩时析出Li2CO3 热水 ③ 6.0×108 2Li2CO3+4CoCO3+O2![]() 4LiCoO2+6CO2
4LiCoO2+6CO2
【解析】
海水(含浓度较大的 LiCl,含少量MgCl2、CaCl2、MnCl2等)中加入纯碱调pH=10,滤渣 1 主要成分有MgCO3、Mg(OH)2、CaCO3和MnCO3,滤液含Li2CO3,加盐酸调pH=5,蒸发浓缩,除去NaCl,再除去Mg(OH)2,加入纯碱生成Li2CO3,通入CO2,生成LiHCO3溶液,最后生成碳酸锂,加入碳酸钴,高温可生成LiCoO2,以此解答该题。
(1)钴酸锂( LiCoO2)中Li元素化合价为+1价,O元素化合价为-2价,该化学式中各元素的化合价的代数和为0,Co元素化合价=2×2-1=+3,由表中溶度积知,碳酸锰难溶于水,因此滤渣1中主要有MgCO3、Mg(OH)2、CaCO3和MnCO3;答案为+3,MnCO3。
(2)加入盐酸除去过量的碳酸钠,否则碳酸锂会在浓缩时析出,损失锂元素;答案为:除去过量的Na2CO3,避免蒸发浓缩时析出Li2CO3。
(3)碳酸锂在水中的溶解度,随温度升高,碳酸锂溶解度减小,“沉锂“时的温度应选高温,用热水洗涤,减少沉淀损失;从投料比看出,序号③的比例中,投入碳酸钠量较小,锂回收率较高,可降低生产成本;答案为热水,③。
(4)pH=13 时,c(OH-)=0.1mol/L,由溶度积可知,“除镁”是将溶液中Mg2+转化为Mg(OH)2沉淀,根据溶度积计算,c(Mg2+)=![]() =
= ![]() =6.0×10-8mol/L;答案为6.0×10-8。
=6.0×10-8mol/L;答案为6.0×10-8。
(5)将Li2CO3与CoCO3混合,再在空气中灼烧可得LiCoO2,Co元素化合物由+2价升高到+3价,发生氧化反应,必有氧气参加反应,反应还生成二氧化碳,反应化学方程式为:2Li2CO3+4CoCO3+O2![]() 4LiCoO2+6CO2;答案为:2Li2CO3+4CoCO3+O2
4LiCoO2+6CO2;答案为:2Li2CO3+4CoCO3+O2![]() 4LiCoO2+6CO2。
4LiCoO2+6CO2。