题目内容
18.把下列4种X溶液分别加入4个盛有10mL2mol/L盐酸的烧杯中,均加入水稀释到50mL,此时,X和盐酸缓慢地进行反应,其中反应速率最快的是( )| A. | 10℃20mL3 mol/L的X溶液 | B. | 20℃30mL2 mol/L的X溶液 | ||
| C. | 20℃10mL4 mol/L的X溶液 | D. | 10℃20mL2 mol/L的X溶液 |
分析 先计算出稀释后X溶液的中X的物质的量,最后溶液的体积都为50mL,则物质的量越大,浓度越大,则反应速率越大;并结合温度越高,反应速率越大来判断.
解答 解:BC温度高与AD,所以BC反应速率高于AD,B中含有X0.03L×2mol/L=0.06mol,C中含有X0.01L×4mol/L=0.04mol,溶液体积相同,所以B中浓度大于C,显然四种情况下B中温度最高,浓度最大,所以反应速率是最快,故选B.
点评 本题考查反应速率与温度、浓度的关系及物质的量的计算,难度不大.明确影响化学反应速率的因素、物质的量与浓度的关系是解答本题的关键.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
8.某工业含锰酸性废水的主要成分为MnSO4,另外还存在Fe2+、Fe3+、Al3+等离子.现以该废水为原料,制备高纯的碳酸锰,工业流程如下:
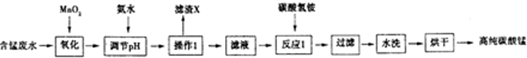
(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
依据表中数据判断,用氨水调节溶液的pH应至5.2.
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.

(1)加入MnO2的作用是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O(用离子方程式表示).
(2)下表列出了几种离子生成氢氧化物沉淀时的pH
| 开始沉淀时的pH | 沉淀完全时的pH | |
| Fe3+ | 1.5 | 3.1 |
| Fe2+ | 6.5 | 9.7 |
| Al3+ | 3.3 | 5.2 |
| Mn2+ | 7.8 | 10.4 |
(3)滤渣X的主要成分为Fe(OH)3、Al(OH)3,滤液中的溶质为MnSO4、(NH4)2SO4.
(4)已知反应1中会产生一种气体,则该反应的化学方程式为2NH4HCO3+MnSO4=MnCO3+(NH4)2SO4+CO2↑+H2O.
(5)判断水洗步骤中沉淀已洗净的方法是取最后一次的洗涤液于试管中,加入BaCl2溶液和稀硝酸,若无白色沉淀,说明已洗净.
(6)制得的碳酸锰可用于工业上电解法冶炼金属锰.该生产中需先将碳酸锰溶于强酸,配成电解液,写出该反应的离子方程式MnCO3+2H+=Mn2++CO2↑+H2O.
6.下列说法正确的是( )
| A. | 某烷烃的名称为2,2,4,4-四甲基-3,3,5-三乙基己烷 | |
| B. | 乙醇、乙酸和乙酸乙酯不能用饱和Na2CO3溶液鉴别 | |
| C. | 化合物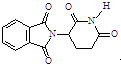 在酸性条件下水解,所得溶液加碱加热后有NH3生成 在酸性条件下水解,所得溶液加碱加热后有NH3生成 | |
| D. | 桶烯(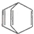 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 )与苯乙烯(C6H5CH=CH2)互为同分异构体,均属于芳香烃 |
13.下列有关化学用语使用正确的是( )
| A. | NH3分子的结构式: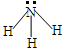 | |
| B. | NH4Cl的电子式: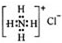 | |
| C. | 原子核内有10个中子的氧原子:818O | |
| D. | Cl-离子的结构示意图: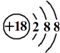 |
3.化学与生活密切相关,下列有关说法正确的是( )
| A. | 油脂、乙酸乙酯都属于酯类,水解后都会生成乙醇 | |
| B. | 将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色 | |
| C. | 煤经气化和液化两个物理变化过程,可变为清洁能源 | |
| D. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 |
8.美国天文学家在亚利桑那州一天文观察台探测到了银河系中心2.6万光年处一巨大气云中的特殊电磁波,这种电磁波表明那里可能有乙醇醛糖分子存在.下列有关乙醇醛糖(HOCH2CHO)的有关说法正确的( )
| A. | 乙醇醛糖是一种有机物,不易溶于水 | |
| B. | 乙醇醛糖能发生取代反应、加成反应、氧化反应以及还原反应 | |
| C. | 乙醇醛糖与甲酸乙酯互为同分异构体 | |
| D. | 1 mol 乙醇醛糖与足量的银氨溶液作用,可析出1 molAg |
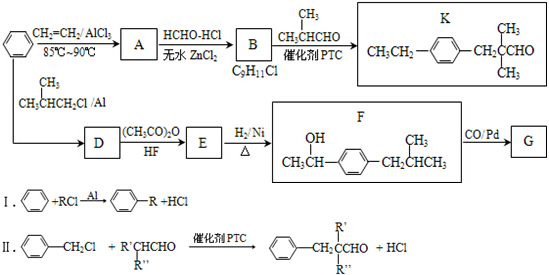
 .
.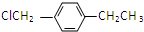 .
.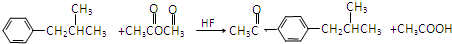 .
.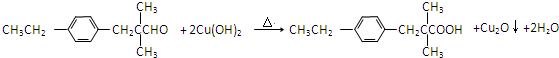
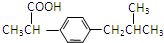 .
.