题目内容
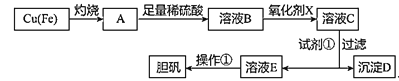
【题目】如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)溶液B中含有的阳离子有__(填离子符号)。
(2)下列物质中最适宜做氧化剂X的是__(填字母)。
A.NaClO B.H2O2 C.KMnO4
写出加入氧化剂X时,发生反应的离子方程式___。
(3)加入试剂①是为了调节pH,试剂①可以选择__(填化学式)。
已知:残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。则Fe(OH)3的溶度积常数Ksp=___。
(4)操作①的步骤:___、___、过滤、洗涤、干燥。
(5)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是__。
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.将FeCl3溶液滴加到淀粉-KI溶液中,溶液显蓝色
C.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液中出现红色沉淀
【答案】Cu2+、Fe2+、Fe3+、H+ B 2Fe2++H2O2+2H+=2Fe3++2H2O CuO或Cu(OH)2或CuCO3 10-35.9 蒸发浓缩 冷却结晶 CD
【解析】
由制备实验流程可知,Fe和Cu灼烧,铜与氧气反应生成CuO,Fe与氧气反应生成四氧化三铁,加入足量稀硫酸溶解,反应生成硫酸铜和硫酸亚铁、硫酸铁,由完全生成氢氧化物沉淀时溶液的pH可知,需将二价铁氧化生成三价铁,然后调节pH形成沉淀,过滤除去氢氧化铁沉淀,滤液E经蒸发浓缩、冷却结晶、过滤、洗涤、干燥可得胆矾,据此分析解答。
(1)根据上面的分析可知,溶液B为硫酸铜和硫酸亚铁、硫酸铁的混合溶液及过量的稀硫酸,其中含有的阳离子有Fe2+、Fe3+、H+、Cu2+,故答案为:Fe2+、Fe3+、H+、Cu2+;
(2)氧化剂X是将亚铁离子氧化成铁离子,同时不能引入新的杂质,所以可以用H2O2,过氧化氢具有强氧化性,可将Fe2+氧化成Fe3+,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,故答案为:b;2Fe2++H2O2+2H+=2Fe3++2H2O;
(3)加入试剂①是为了调节pH,与溶液中的氢离子反应,同时不能引入新的杂质,试剂①可以选择CuO或CuCO3或Cu(OH)2;残留在溶液中的离子浓度小于1×10-5mol/L时,根据表格数据可知,铁离子完全沉淀时的pH≥3.7,则Fe(OH)3的溶度积常数Ksp= c(Fe3+)×c3(OH-)=1×10-5×[1×10-(14-3.7)]3=10-35.9,故答案为:CuO或CuCO3或Cu(OH)2;10-35.9;
(4)操作①是从硫酸铜溶液中获得硫酸铜晶体,操作步骤为:蒸发浓缩、冷却结晶,过滤、洗涤、干燥,故答案为:蒸发浓缩、冷却结晶;
(5)A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体为氢氧化铁胶体,氢氧化铁胶体能产生丁达尔效应,故A正确;B.FeCl3具有氧化性,能够氧化KI生成I2,碘遇到淀粉溶液显蓝色,故B正确;C.将FeCl3溶液加热蒸干并灼烧,由于氯化铁水解生成氢氧化铁,最终得到Fe2O3固体,故C错误;D.向FeCl3溶液中滴加KSCN溶液生成Fe(SCN)3,溶液变为血红色,没有沉淀生成,故D错误;故选CD;

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】苯甲醛在碱性条件下可发生反应: 2C6H5CHO + NaOH→C6H5CH2OH+C6H5COONa。相关物质的物理性质如下表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |||
溶 解 性 | 水中 | 微溶 | 微溶 | 温度 | 溶解度 | 不溶 |
17℃ | 0.21 g | |||||
25℃ | 0.34 g | |||||
100℃ | 5.9 g | |||||
有机溶剂中 | 易溶 | 易溶 | 易溶 | 易溶 | ||
密度(20℃)/g·cm-3 | 1.0 | 1.0 | 1.3 | 0.9 | ||
沸点/℃ | 178 | 205 | 249 | 80 | ||
熔点/℃ | 26 | -15 | 122 | 5.4 | ||
制备苯甲醇和苯甲酸的实验流程及涉及的主要实验装置(部分加热和固定装置已略)如下:
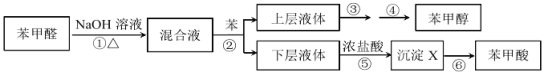
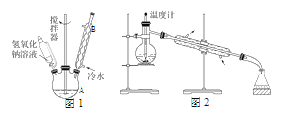
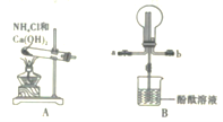
(1)第①步所用装置(如图 1),用搅拌器的目的是______________。仪器 B 的作用是_______________。
(2)第②步所用玻璃仪器有烧杯、_______________。
(3)第③步采用沸水浴加热蒸馏,收集到的馏分为_________;再进行第④步,操作如图 2 所示。图 2 中有一处明显错误,正确的应改为_________________________。
(4)第⑤步反应的离子方程式为________________________________________; 冷水洗涤沉淀 X 的优点是_________________________;检验沉淀 X 洗涤干净与否的操 作:______________。
(5)第⑥步经过滤、洗涤、干燥得苯甲酸产品,然后用电子天平准确称取 0.2440 g 苯甲酸样品于锥形瓶中,加 100 mL 蒸馏水溶解,再用 0.1000 mol·L-1 的标准 NaOH 溶液 进行滴定,经平行实验,测得消耗 NaOH 溶液的平均值为 19.20 mL,则苯甲酸样品的纯 度为_________ (质量百分数)。