题目内容
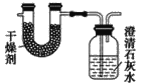
【题目】某化学实验小组同学利用如图所示装置制备氨气,并探究氨气的性质(部分仪器已略去)。请回答:
I.实验室制备氨
(1)实验室制备氨气的化学方程式为_______;干燥氨气常用的干燥剂是__________。
(2)若观察到装置B中的烧瓶内产生了红色喷泉,则说明氨气具有的性质是______。
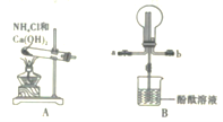
II.探究NH3的还原性。用氨气和如图所示仪器设计实验。

(3)①NH3与Na2O2反应不会生成NO、NO2的现象是__________。
②检验产物是否有H2O等,按气流从左至右,仪器连接顺序为__________。
(4)G装置的作用是____________。
(5)实验完毕后,D装置中收集到一定量气体;将E中得到的固体加入少量酚酞试液中,观察到溶液变红;F装置中无水CuSO4不变蓝,据此写出E中反应的化学方程式:______。
【答案】2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O 碱石灰 极易溶于水,与水反应生成碱 F中气体不会变成红棕色 E、F、G、D 吸收多余的氨气并防止倒吸 2NH3+3Na2O2==N2+6NaOH
CaCl2+2NH3↑+2H2O 碱石灰 极易溶于水,与水反应生成碱 F中气体不会变成红棕色 E、F、G、D 吸收多余的氨气并防止倒吸 2NH3+3Na2O2==N2+6NaOH
【解析】
(1)实验室制备氨气,用NH4Cl与Ca(OH)2在加热的条件下反应;干燥氨气常用碱性干燥剂。
(2)若观察到装置B中的烧瓶内产生了红色喷泉,一方面表明氨气在水中的溶解度大,另一方面表明溶解后的产物显碱性。
(3)①NH3与Na2O2反应不会生成NO、NO2,则不产生NO2表现的气体颜色。
②检验产物是否有H2O等,应使用F装置,且在气体通入溶液前进行。
(4)G装置氨气不溶于CCl4,逸出后被硫酸吸收。
(5)实验完毕后,D装置中收集到一定量气体,则气体不易溶于水;将E中得到的固体加入少量酚酞试液中,观察到溶液变红,则固体显碱性;F装置中无水CuSO4不变蓝,则不生成水。
(1)实验室制备氨气,用NH4Cl与Ca(OH)2在加热的条件下反应,化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;干燥氨气,不能用浓硫酸和无水氯化钙,常用的干燥剂是碱石灰。答案为:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O;干燥氨气,不能用浓硫酸和无水氯化钙,常用的干燥剂是碱石灰。答案为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;碱石灰;
CaCl2+2NH3↑+2H2O;碱石灰;
(2)装置B中的烧瓶内产生了红色喷泉,则表明氨气在水中的溶解产物显碱性,则说明氨气具有的性质是极易溶于水,与水反应生成碱。答案为:极易溶于水,与水反应生成碱;
(3)①NH3与Na2O2反应不会生成NO、NO2,则气体不呈现NO2的颜色,现象是F中气体不会变成红棕色。答案为:F中气体不会变成红棕色;
②检验产物是否有H2O等,应使用F装置,且在气体通入溶液前进行,按气流从左至右,仪器连接顺序为E、F、G、D。答案为:E、F、G、D;
(4) G装置氨气不溶于CCl4,逸出后被硫酸吸收,则G装置的作用是吸收多余的氨气并防止倒吸。答案为:吸收多余的氨气并防止倒吸;
(5)实验完毕后,D装置中收集到的气体不易溶于水;E中固体显碱性;F装置中无水CuSO4不变蓝,则不生成水。由此可确定,固体不可能为Na2O、Na2O2,只能为NaOH,气体只能为N2,据此得出E中反应的化学方程式:2NH3+3Na2O2==N2+6NaOH。答案为:2NH3+3Na2O2==N2+6NaOH。

 新课标阶梯阅读训练系列答案
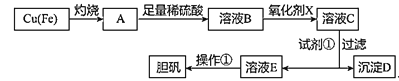
新课标阶梯阅读训练系列答案【题目】如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)溶液B中含有的阳离子有__(填离子符号)。
(2)下列物质中最适宜做氧化剂X的是__(填字母)。
A.NaClO B.H2O2 C.KMnO4
写出加入氧化剂X时,发生反应的离子方程式___。
(3)加入试剂①是为了调节pH,试剂①可以选择__(填化学式)。
已知:残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。则Fe(OH)3的溶度积常数Ksp=___。
(4)操作①的步骤:___、___、过滤、洗涤、干燥。
(5)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是__。
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.将FeCl3溶液滴加到淀粉-KI溶液中,溶液显蓝色
C.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液中出现红色沉淀