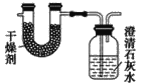
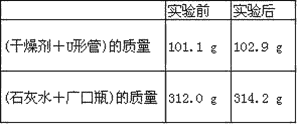
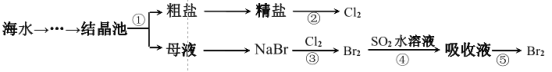
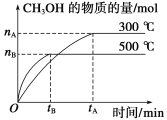
题目内容
【题目】下列对各电解质溶液的分析不正确的是
A.硫酸氢钠溶液中:c(H+)=c(OH-)+c(SO42-)
B.向稀氨水中滴加稀盐酸至恰好中和:c(NH4+)<c(Cl-)
C.0.l mol·L-1 Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=c(Na+)
D.向CH3COONa溶液中加适量蒸馏水:c(CH3COO-)与c(OH-)都减小,c(OH-)/c(CH3COO-)增大
【答案】C
【解析】
A.硫酸氢钠溶液中存在电荷守恒:![]() ,物料守恒:
,物料守恒:![]() ,所以
,所以![]() ,故A不符合题意;
,故A不符合题意;
B.向稀氨水中滴加稀盐酸至恰好中和,所得溶液为氯化铵溶液,![]() 水解使溶液显酸性,c(H+)>c(OH-),由电荷守恒可知:
水解使溶液显酸性,c(H+)>c(OH-),由电荷守恒可知:![]() ,所以
,所以![]() ,故B不符合题意;
,故B不符合题意;
C.Na2S溶液中存在物料守恒,所以![]() ,故C符合题意;
,故C符合题意;
D.向CH3COONa溶液中加适量蒸馏水促进CH3COO-的水解,n(CH3COO-)减小,n(OH-)增大,所以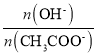 增大,
增大,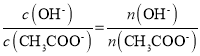 ,则
,则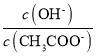 增大,故D不符合题意;
增大,故D不符合题意;
故答案为:C。

 一线名师提优试卷系列答案
一线名师提优试卷系列答案【题目】(1)室温下,在0.5 mol/L的纯碱溶液中加入少量水,由水电离出的c(H+)·c(OH-)_______ (填“变大”、“变小”、“不变”)。
(2)已知Ksp(Ag2CrO4)=1.0×10-12,向0.2 moL的AgNO3溶液中加入等体积的0.08 mol/L K2CrO4溶液,则溶液中的c(CrO42-)=________。
(3)室温下,0.1 mol/L NaHCO3溶液的pH值________0.1 mol/LNa2SO3溶液的pH值(填“>”、“<”、“=”)。
已知:
酸 | 电离平衡常数 | |
H2CO3 | K1=4.3×10-7 | K2=5.6×10-11 |
H2SO3 | K1=1.54×10-2 | K2=1.02×10-7 |
(4)有一种可充电电池Na—Al/FeS,电池工作时Na+的物质的量保持不变,并且是用含![]() 的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
的导电固体作为电解质,已知该电池正极反应式为2Na++FeS+2e-=Na2S+Fe,该电池在充电时,阳极发生反应的物质是________,放电时负极反应式为________。
【题目】如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
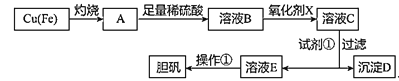
溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)溶液B中含有的阳离子有__(填离子符号)。
(2)下列物质中最适宜做氧化剂X的是__(填字母)。
A.NaClO B.H2O2 C.KMnO4
写出加入氧化剂X时,发生反应的离子方程式___。
(3)加入试剂①是为了调节pH,试剂①可以选择__(填化学式)。
已知:残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。则Fe(OH)3的溶度积常数Ksp=___。
(4)操作①的步骤:___、___、过滤、洗涤、干燥。
(5)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是__。
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.将FeCl3溶液滴加到淀粉-KI溶液中,溶液显蓝色
C.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液中出现红色沉淀