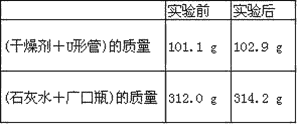
题目内容
【题目】碳及其化合物在科研、工业生产中有着重要作用。请按要求回答下列问题。
(1)一定条件下,CH4 和 CO2 都能与 H2O 形成笼状结构的水合物晶体,CH4 与 H2O形成的水合物俗称“可燃冰”。已知:CO2(g)+nH2O(l)=CO2·nH2O(s)△H=-57.98 kJ·mol-1, CH4(g)+nH2O(l)=CH4·nH2O(s) △H=-54.49 kJ·mol-1 。则反应: CO2(g)+CH4·nH2O(s) = CH4(g) +CO2·nH2O(s)的△H=_______________;该反应能在一定 条件下自发进行的理论依据是______________。
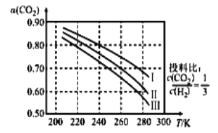
(2)固定和利用 CO2 能有效地利用资源并减少空气中的温室气体。工业上利用 CO2 生产甲醇方法的反应原理:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。现将6mol CO2 和 8 mol H2 充入一容积为 2 L 的密闭容器中(温度保持不变),测得 H2 的物质的量随时间变化如下图实线所示。
CH3OH(g)+H2O(g) ΔH<0。现将6mol CO2 和 8 mol H2 充入一容积为 2 L 的密闭容器中(温度保持不变),测得 H2 的物质的量随时间变化如下图实线所示。
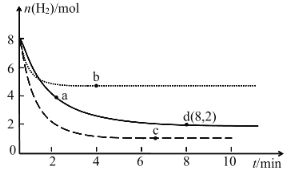
①该反应在 0~8 min 时,H2 的平均反应速率:_____________;v 正(a)_____________v 正(d)(填“<”“>”“=”);CO2 的平衡转化率:_____________。该温度下平衡常数的值 为_____________。
②若起始反应物投料量不变,重新进行两次实验(每次仅改变某一条件),所测得 H2 的物质的量随时间变化如上图中两条虚线。则 b、c、d 三点平衡常数: K(b)______________K(c)______________K(d)(填“<”“>”“=”)。
③在恒温恒容的条件下,再充入 3 mol CO2 和 4 mol H2,达新平衡时,H2O 的体积分数将______________(填“增大”“不变”或“减小”)
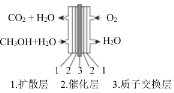
(3)如图为甲醇燃料电池,其负极电极 方程式为______________。
【答案】-3.49 kJ·mol-1 △G=△H- T·△S<0 0.375mol·L-1·min-1 > 33.3% 0.5 < = 增大 CH3OH-6e-+ H2O = CO2+6H+
【解析】
(1)由盖斯定律可知,CO2(g)+nH2O(l)=CO2·nH2O(s)△H=-57.98 kJ·mol-1,CH4(g)+nH2O(s) =CH4·nH2O(s) △H=-54.49 kJ·mol-1,以上两个式子相减得CO2(g)+CH4·nH2O(s)=CH4(g) +CO2·nH2O(s) △H=(-57.98 kJ·mol-1)-(-54.49)=-3.49 kJ·mol-1;判断反应能否自发进行,依据△G=△H- T·△S,若△G<0,反应能自发进行;△G>0反应不能自发进行,因为该反应的△H=-3.49 kJ·mol-1<0,所以一定条件下能自发进行;
(2)①计算0~8 min 时,H2 的物质的量的变化,求出H2 的物质的量浓度的变化,依据反应中反应物、生成物物质的量变化之比等于化学计量数之比,计算出△n(CO2)、△n(CH3OH)、△n(H2O),然后计算出平衡时的反应物、生成物的物质的量浓度;
②如图所示,以d点实线曲线为标准分析,b点曲线反应速率增大,但转化的氢气的物质的量少,应是升高温度,因该反应放热,升高温度平衡逆向移动;c点曲线反应速率增大,转化的氢气的物质的量多,平衡正向移动,应是增大压强;平衡常数只受温度的影响,该反应放热,升高温度平衡逆向移动,平衡常数减小;
③借助于等效平衡处理该题,达到平衡后在通入反应物物质的量之比与平衡前通入反应物的物质的量之比相等,相当于增大压强,反应物生成物浓度同等倍数增加。
(3)甲醇燃料电池,负极发生氧化反应,正极发生还原反应,图中的交换层为质子交换层,故电解质为酸,负极的电极反应式:CH3OH-6e-+ H2O = CO2+6H+。
(1)由盖斯定律可知,CO2(g)+nH2O(l)=CO2·nH2O(s)△H=-57.98 kJ·mol-1,CH4(g)+nH2O(s)=CH4·nH2O(s) △H=-54.49 kJ·mol-1,以上两个式子相减得CO2(g)+CH4·nH2O(s)= CH4(g) +CO2·nH2O(s) △H=(-57.98 kJ·mol-1)-( -54.49)=-3.49kJ·mol-1;根据体系自由能变化△G=△H- T·△S,判断反应能否自发进行,若△G=△H-T·△S<0,反应能自发进行;
(2)①该反应在0~8 min时,△n(H2)=8mol-2mol=6mol,v(H2)=![]() =0.375mol·L-1·min-1;由a到d的过程,反应物的浓度逐渐减小,正反应速率逐渐变慢,故v正(a)>v正(d);反应中变化的物质的量之比等于化学计量数之比,因为△n(H2)=6mol,所以△n(CO2)=2mol,△n(CH3OH)=△n(H2O)=2mol,CO2的平衡转化率:
=0.375mol·L-1·min-1;由a到d的过程,反应物的浓度逐渐减小,正反应速率逐渐变慢,故v正(a)>v正(d);反应中变化的物质的量之比等于化学计量数之比,因为△n(H2)=6mol,所以△n(CO2)=2mol,△n(CH3OH)=△n(H2O)=2mol,CO2的平衡转化率:![]() ×100%=33.3%;平衡时n(H2)=8mol-6mol=2mol,n(CO2)=6mol-2mol=4mol,n(CH3OH)=n(H2O)=2mol,平衡时反应物生成物的物质的量浓度为:c(H2)=c(CH3OH)=c(H2O)=
×100%=33.3%;平衡时n(H2)=8mol-6mol=2mol,n(CO2)=6mol-2mol=4mol,n(CH3OH)=n(H2O)=2mol,平衡时反应物生成物的物质的量浓度为:c(H2)=c(CH3OH)=c(H2O)= ![]() =1mol·L-1,c(CO2) =
=1mol·L-1,c(CO2) =![]() =2 mol·L-1,该温度下平衡常数的值为:
=2 mol·L-1,该温度下平衡常数的值为:![]() =0.5;
=0.5;
②根据图像,b点曲线反应速率增大,但与d点所在的实线曲线相比,转化的氢气的物质的量少,应是升高温度,因CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0,该反应正反应为放热反应,升高温度平衡逆向移动,不利于氢气的转化,故b点曲线改变的条件是升高温度;c点曲线反应速率增大,但与d
CH3OH(g)+H2O(g) ΔH<0,该反应正反应为放热反应,升高温度平衡逆向移动,不利于氢气的转化,故b点曲线改变的条件是升高温度;c点曲线反应速率增大,但与d
③在恒温恒容的条件下,再充入3mol CO2和4 molH2,相当于同等倍数的增大反应物的物质的量浓度,压强增大,平衡向着气体分子数减小的方向(正反应方向)移动,H2O 的体积分数将增大;
(3)甲醇燃料电池,负极发生氧化反应,图中的交换层为质子交换层,故电解质为酸,负极的电极反应式:CH3OH-6e-+ H2O = CO2+6H+。

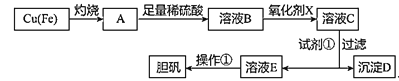
【题目】如图是利用废铜屑(含杂质铁)制备胆矾(硫酸铜晶体)的流程。
溶液中被沉淀离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)溶液B中含有的阳离子有__(填离子符号)。
(2)下列物质中最适宜做氧化剂X的是__(填字母)。
A.NaClO B.H2O2 C.KMnO4
写出加入氧化剂X时,发生反应的离子方程式___。
(3)加入试剂①是为了调节pH,试剂①可以选择__(填化学式)。
已知:残留在溶液中的离子浓度小于1×10-5mol/L时,沉淀就达完全。则Fe(OH)3的溶度积常数Ksp=___。
(4)操作①的步骤:___、___、过滤、洗涤、干燥。
(5)沉淀D加入盐酸可以得到FeCl3,关于FeCl3溶液的性质中说法不正确的是__。
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.将FeCl3溶液滴加到淀粉-KI溶液中,溶液显蓝色
C.将FeCl3溶液加热蒸干并灼烧,得到FeCl3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液中出现红色沉淀