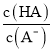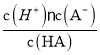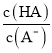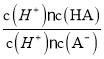题目内容
【题目】从煤和石油中可以提炼出化工原料A和H。已知A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志。H是一种比水轻的油状液体,H仅由碳氢两种元素组成,H不能使酸性KMnO4溶液褪色,其碳元素与氢元素的质量比为12:l,H的相对分子质量为78。下列是有机物A~G之间的转化关系:

请回答下列问题:
(1)D中所含官能团的名称是_________________;
(2)写出反应③的化学方程式_______________________________________;
(3)G是一种高分子化合物,可以用来制造农用薄膜材料等,其结构简式__________;
(4)在体育竞技比赛中,当运动员肌肉挫伤或扭伤时,随队医生立即对准其受伤部位喷射物质F(沸点12.27℃)进行应急处理。写出由A制备F的化学方程式:___________;
(5)下列关于B的一种同系物甲醇的说法不正确的是___________(填字母)。
a.甲醇的结构简式为CH3OH,官能团为—OH
b.甲醇完全燃烧后的产物为CO2和H2O
c.B与甲醇都极易溶于水,是因为它们都能与水分子间形成氢键
d.甲醇与钠反应可以产生氢气,所以甲醇显酸性
(6)等质量的A、H完全燃烧时消耗O2的物质的量_______(填“A>H、A<H或A=H”)。
【答案】 羧基 2CH3CH2OH+O2![]() 2CH3CHO+2H2O
2CH3CHO+2H2O ![]() CH2=CH2 + HCl
CH2=CH2 + HCl ![]() CH3CH2Cl d A>H
CH3CH2Cl d A>H
【解析】
从煤和石油中可以提炼出化工原料A和H。已知A是石油裂解气的主要产物之一,其产量是衡量一个国家石油化工发展水平的标志,A是乙烯。乙烯和氯化氢发生加成反应生成F是CH3CH2Cl。乙烯和水发生加成反应生成B是乙醇,乙醇发生催化氧化生成C是乙醛,乙醇被酸性高锰酸钾溶液氧化生成D是乙酸,乙酸和乙醇发生酯化反应生成E是乙酸乙酯。H是一种比水轻的油状液体,H仅由碳氢两种元素组成,H不能使酸性KMnO4溶液褪色,其碳元素与氢元素的质量比为12:l,H的相对分子质量为78,则含有的碳原子个数是![]() ,氢原子个数是
,氢原子个数是![]() ,因此H是苯,据此解答。
,因此H是苯,据此解答。
根据以上分析可知A是CH2=CH2,B是CH3CH2OH,C是CH3CHO,D是CH3COOH,E是CH3COOC2H5,F是CH3CH2Cl。则
(1)D是乙酸,其中所含官能团的名称是羧基;
(2)反应③是乙醇的催化氧化,化学方程式为2CH3CH2OH+O2![]() 2CH3CHO+2H2O;
2CH3CHO+2H2O;
(3)G是一种高分子化合物,可以用来制造农用薄膜材料等,因此G是聚乙烯,其结构简式为![]() ;
;
(4)乙烯和氯化氢发生加成反应生成氯乙烷,反应的化学方程式为CH2=CH2 + HCl ![]() CH3CH2Cl;
CH3CH2Cl;
(5)a.甲醇的结构简式为CH3OH,官能团为-OH,a正确;
b.甲醇完全燃烧后的产物为CO2和H2O,b正确;
c.B与甲醇都极易溶于水,是因为它们都能与水分子间形成氢键,c正确;
d.甲醇含有羟基,与钠反应可以产生氢气,甲醇是非电解质,不显酸性,d错误。
答案选d。
(6)乙烯分子中氢元素含量高于苯中氢元素含量,含氢量越高,消耗的氧气越多,则等质量的A、H完全燃烧时消耗O2的物质的量A>H。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案【题目】在2 L密闭容器内,t℃时发生反应:N2(g)+3H2(g)![]() 2NH3(g),在体系中,n(N2)随时间的变化如下表:
2NH3(g),在体系中,n(N2)随时间的变化如下表:
时间(min) | 0 | 1 | 2 | 3 | 4 | 5 |
N2的物质的量(mol) | 0.20 | 0.10 | 0.08 | 0.06 | 0.06 | 0.06 |
(1)上述反应在第5min时,N2的转化率为_______________________;
(2)用H2表示从0~2 min内该反应的平均速率v(H2)=_____________;
(3)t℃时,在4个均为2L密闭容器中不同投料下进行合成氨反应。根据在相同时间内测定的结果,判断该反应进行快慢的顺序为______________。(用字母填空,下同);
a.v(NH3)=0.05 mol·L-1·min-1 b.v(H2)=0.03 mol·L-1·min-1
c.v(N2)=0.02 mol·L-1·min-1 d.v(H2)=0.00 l mol·L-1·s-1
(4)下列表述能作为反应达到化学平衡状态的标志是_____________。
a.反应速率v(N2):v(H2):v(NH3)=1:3:2
b.各组分的物质的量浓度不再改变
c.混合气体的平均相对分子质量不再改变
d.混合气体的密度不变
e.单位时间内生成n mol N2的同时,生成3n mol H2
f.v(N2)消耗=2v(NH3)消耗
g.单位时间内3mol H—H键断裂的同时2mol N—H键也断裂