题目内容
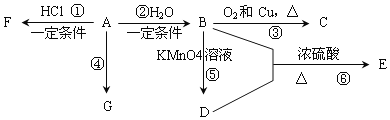
【题目】某同学在实验室利用氢氧化钠、盐酸分离铁粉和铝粉混合物,转化关系如下如所示:下列说法不正确的是( )

A. x为NaOH溶液,y为盐酸
B. a→b发生的反应为:AlO2-+H++H2O=Al(OH)3↓
C. 按照本流程,x和y调换后也能达到实验目的
D. b、c既能与强酸又能与强碱反应
【答案】C
【解析】根据转化关系,加入试剂x,得到溶液和Fe,利用Al能与NaOH反应,Fe不与NaOH反应,因此试剂x为NaOH,即a的主要成分是NaAlO2,根据转化关系,试剂y应为盐酸,发生AlO2-+H++H2O=Al(OH)3↓,然后氢氧化铝受热分解成Al2O3,最后通过电解的方法得到金属Al,A、根据上述分析,x为NaOH溶液,y为盐酸,故A说法正确;B、a→b的反应是AlO2-+H++H2O=Al(OH)3↓,故B说法正确;C、如果x和y互换,a为FeCl2和AlCl3,加入NaOH,则得到Fe(OH)2和Al(OH)3,按照流程无法得到金属铝,故C说法错误;D、b和c分别是Al(OH)3和Al2O3,都属于两性化合物,既能与强酸反应,又能与强碱反应,故D说法正确。

 名校课堂系列答案
名校课堂系列答案【题目】请按要求填写下列空白:
主族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
2 | ① | ② | ③ | ④ | |||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)在元素①②⑤⑥⑦⑧对应的最高价氧化物的水化物中,碱性最强的化合物的电子式是:_________________________________________;
(2)写出元素②的最简单氢化物的结构式_________________________;
(3)④⑤⑥⑦四种元素的简单离子半径从大到小排序____________(用离子符号表示);
(4)写出元素⑥的最高价氧化物与元素⑤的最高价氧化物的水化物反应的离子方程式______;
(5)写出元素③的常见氢化物和它的最高价氧化物的水化物反应的化学方程式____________。